

Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



\(m_{ddCuCl_2}=1,2.300=360\left(g\right)\)
=> \(m_{CuCl_2}=\dfrac{360.20}{100}=72\left(g\right)\)
=> \(n_{CuCl_2}=\dfrac{72}{135}=\dfrac{8}{15}\left(mol\right)\)
PTHH: Zn + CuCl2 --> ZnCl2 + Cu
_____a----->a--------->a-------->a
=> 25 - 65a + 64a = 18
=> a = 7 (sai đề)

Khối lượng dung dịch CuSO 4 : m dd CuSO 4 = 1,12 x 50 = 56 (gam).
CuSO 4 + Fe → FeSO 4 + Cu
64x — 56x = 5,16 - 5 = 0,16 (gam) => x = 0,02 mol.
m CuSO 4 tham gia phản ứng = 0,02 x 160 = 3,2 (gam);
100 gam dung dịch CuSO 4 có 15 gam CuSO 4 nguyên chất.
56 gam dung dịch CuSO 4 có X gam CuSO 4 nguyên chất.
x = 56 x 15/100 = 8,4g; m CuSO 4 còn lại = 8,4 - 3,2 = 5,2g
m FeSO 4 = 0,02 x 152 = 3,04g
m dd sau p / u = 56 - 0,16 = 55,84g
C % CuSO 4 = 5,2/55,84 x 100% = 9,31%
C % FeSO 4 = 3,04/55,84 x 100% = 5,44%

khối lượng lá kẽm giảm <=> số mol Zn pư = 0,1 mol
Viết pt => số mol Hcl pư =0,2 mol
Theo bài : số mol HCl đem dùng = 40/73 mol
=> số mol HCl dư = 127/365 mol
Lại có: khối lượng d2 thu được sau pư là: 6.5+200-0,2=206,3 mol
=>nồng độ d HCl sau pư là: 6.16%

* Nhận xét: “sau một thời gian phản ứng”, suy ra CuSO4 có thể vẫn còn dư. Gọi số mol Fe phản ứng là x mol.
a) Phương trình hóa học:
Fe + CuSO4 → FeSO4 + Cu
P/ư: x x x x mol
Khối lượng lá sắt tăng = 2,58 - 2,5 = 0,08 gam. Ta có phương trình:
64x - 56x = 0,08
x = 0,01 mol
b) Sô mol CuS04 ban đầu = 0,02625 mol
Trong dung dịch sau phản ứng có hai chất tan là FeSO4 0,01 mol và CuSO4 dư 0,01625 mol.
Khối lượng dung dịch:
mdd = + mFe(p.ư) – mCu = 25.1,12 + 0,01.56 - 0,01.64 = 27,91 g
C%, CuS04 = .100% ≈ 9,32%
C%, FeSO4 = .100% ≈ 5,45%
* Nhận xét: “sau một thời gian phản ứng”, suy ra CuSO4 có thể vẫn còn dư.
Gọi số mol Fe phản ứng là x mol.
a) Phương trình hóa học:
Fe + CuSO4 → FeSO4 + Cu
1 mol Fe phản ứng thì khối lượng sắt tăng: 64-56 = 8 gam
x mol Fe → 2,58 -2,5 = 0,08 gam
⇒ x = 0,01 mol
b) Số mol CuSO4 ban đầu
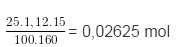
Trong dung dịch sau phản ứng có hai chất tan là FeSO4 0,01 mol và CuSO4 dư 0,01625 mol.
Khối lượng dung dịch:



vậy
m dd s a u = m d d t r u o c + m F e ( p u ) − m C u ( s p ) m d d s a u = 28 + 0,0075.56 − 0,0075.64 = 27,94 g a m ⇒ C % ( F e S O 4 ) = 0,0075.152 27,94 .100 = 4,08 % ⇒ C % ( C u S O 4 ) = 0,01875.160 27,94 .100 = 10,74 %
⇒ Chọn A.

mddCuSO4 = 25.1,12 = 28g
⇒mCuSO4 = 4,2g
⇒nCuSO4 = 0,02625mol
Fe + CuSO4→→ FeSO4 + Cu
x →→ x-----------------x---------x
mtăng = 64x-56x = 0,08g
⇒ x=0,01mol
nFe(bđ)= 5/112 mol ⇒⇒ Fe dư, CuSO4 dư ( vì phản ứng ko hoàn toàn)
⇒⇒trong dd sau pứ có FeSO4=0,01mo; CuSO4=0,01625mol
mdd = mCuSO4 + mFepư - mCu = mddCuSO4 - mgiảm =28 - 0,08 = 27,92g
⇒ C% FeSO4 = 0,01(56 + 96).100/ 27,92 = 5,44%
C% CuSO4 = 0,01625.(64 + 96).100/27,92 = 9,31%

\(n_{CuSO_4}=\dfrac{40.20}{100}:160=0,05\left(mol\right)\)
\(Fe+CuSO_4\rightarrow FeSO_4+Cu\)
x x x x
Gọi x là số mol Fe pứ.
có: \(64x-56x=4,5-4,2=0,3\)
<=> 8x = 0,3
=> x = 0,0375
=> \(n_{Fe\left(pứ\right)}=n_{CuSO_{4\left(pứ\right)}}=n_{FeSO_{4\left(pứ\right)}}=x=0,0375\left(mol\right)\)
Vì: \(\dfrac{0,0375}{1}< \dfrac{0,05}{1}\) nên dd \(CuSO_4\) dư sau pứ là: \(0,05-0,0375=0,0125\left(mol\right)\)
Có: \(m_{dd}=4,2+40-4,5=39,7\left(g\right)\)
\(C\%_{dd.CuSO_{4\left(sau.pứ\right)}}=\dfrac{0,0125.160.100}{39,7}=5,04\%\)
\(C\%_{dd.FeSO_4}=\dfrac{0,0375.152.100}{39,7}=14,36\%\)

PTHH: Zn + Pb(NO3)2 → Zn(NO3)2 + Pb
(Gọi số mol của Zn là a => Số mol của Pb là a)
Sau 1 thời gian lấy lá kẽm ra thấy khối lượng tăng 1,42 gam = Khối lượng Pb sinh ra bám vào lá kẽm trừ đi khối lượng Zn phản ứng.
<=> 207a - 65a = 1,42
<=> a = 0,01 (mol)
a) Khối lượng chì bám vào kẽm là: 207a = 2,07(g)
b) Đổi: 500 ml = 0,5 l
Số mol của dung dịch Pb(NO3)2 là: 0,5 . 2 = 1 (mol)
So sánh: 0,01 < 1
=> Dung dịch Pb(NO3)2 dư , tính theo Zn
Số mol của Zn(NO3)2 là: 0,01 . 1 = 0,01 (mol)
Nồng độ mol của dung dịch sau khi lấy lá kẽm ra là:
CM = n / V = 0,01 : 0,5 = 0,02M
( Vì thể tích dung dịch k thay đổi đáng kể nên sau phản ứng và lấy lá kẽm ra thì thể tích dung dịch vẫn là 500 ml)
PTHH: Zn + Pb(NO3)2 → Zn(NO3)2 + Pb
(Gọi số mol của Zn là a => Số mol của Pb là a)
Sau 1 thời gian lấy lá kẽm ra thấy khối lượng tăng 1,42 gam = Khối lượng Pb sinh ra bám vào lá kẽm trừ đi khối lượng Zn phản ứng.
<=> 207a - 65a = 1,42
<=> a = 0,01 (mol)
a) Khối lượng chì bám vào kẽm là: 207a = 2,07(g)
b) Đổi: 500 ml = 0,5 l
Số mol của dung dịch Pb(NO3)2 là: 0,5 . 2 = 1 (mol)
So sánh: 0,01 < 1
=> Dung dịch Pb(NO3)2 dư , tính theo Zn
Số mol của Zn(NO3)2 là: 0,01 . 1 = 0,01 (mol)
Nồng độ mol của dung dịch sau khi lấy lá kẽm ra là:
CM = n / V = 0,01 : 0,5 = 0,02M
( Vì thể tích dung dịch k thay đổi đáng kể nên sau phản ứng và lấy lá kẽm ra thì thể tích dung dịch vẫn là 500 ml)
chúc bạn học tốt và nhớ tích đúng cho mình