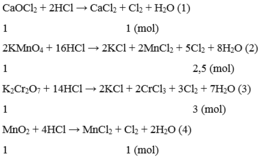Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

1. Theo bài ra, hóa trị của X trong hợp chất với hidro là II nên hóa trị cao nhất trong oxit là VI.
Vậy X thuộc chu kỳ 3, nhóm VIA trong bảng tuần hoàn.
2. R thuộc nhóm VI nên hóa trị cao nhất trong oxit là VI, vậy công thức oxit cao nhất có dạng RO3. Trong oxit này R chiếm 40% khối lượng nên:
![]()
![]() MR = 32.
MR = 32.
3. X là S. Các phương trình phản ứng:
H2S + 4Cl2 + 4H2O \(\rightarrow\) ![]() H2SO4 + 8HCl
H2SO4 + 8HCl
H2S + 2FeCl3 ![]() \(\rightarrow\) 2FeCl2 + S
\(\rightarrow\) 2FeCl2 + S![]() + 2HCl
+ 2HCl
H2S + CuSO4 ![]() \(\rightarrow\)CuS
\(\rightarrow\)CuS![]() + H2SO4
+ H2SO4
Bài này thì có j khó đâu

Câu 1:
Cho giấy quỳ tím ẩm vào ba lọ khí trên:
- Khí nào trong lọ làm đổi màu quỳ tím thành đỏ là khí HCl.
- Khí nào trong lọ tẩy trắng giấy quỳ là khí Cl2.
- Khí nào trong lo không làm đổi màu quỳ tím là khí oxi (dùng que đóm còn than hồng để thử lại).
Câu 2:
Áp dụng CT:
\(C\%=\frac{100.T}{100+T}\)
\(\Leftrightarrow C\%=\frac{40.100}{140}=28,57\%\)
Câu 3:
Gọi số mol Cl2 phản ứng là a
\(2NaBr+Cl_2\rightarrow2NaCl+Br_2\)
\(2KBr+Cl_2\rightarrow2KCl+Br_2\)
\(\Rightarrow n_{Br2}=n_{Cl2}=a\left(mol\right)\)
Gọi khối lượng NaBr và KBr là m
Nên khối lượng NaCl và KCl là m - 4,45
BTKL:
\(71a+m=m-4,45+160a\)
\(\Leftrightarrow a=0,05\left(mol\right)\)
\(\Rightarrow V_{Cl2}=0,05.22,4=1,12\left(l\right)\)
Câu 4:
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(Fe_3O_4+8HCl\rightarrow FeCl_2+2FeCl_3+4H_2O\)
\(AlCl_3+4NaOH\rightarrow NaAlO_2+3NaCl+2H_2O\)
\(FeCl_3+3NaOH\rightarrow Fe\left(OH\right)_3+3NaCl\)
\(FeCl_2+2NaOH\rightarrow Fe\left(OH\right)_2+2NaCl\)
\(2Fe\left(OH\right)_2\rightarrow Fe_2O_3+3H_2O\)
\(Fe\left(OH\right)_2+O_2\rightarrow2Fe_2O_3+4H_2O\)
Kết tủa là Fe2O3
Bảo toàn e:
\(\Rightarrow n_{Fe}=2n_{Fe2O3}\)
\(\Leftrightarrow0,2+0,2.3=2n_{Fe2O3}\)
\(\Leftrightarrow n_{Fe2O3}=0,4\left(mol\right)\)
\(\Rightarrow m_{Fe2O3}=0,4.160=64\left(g\right)\)
Câu 5:
Ta có:
\(\frac{n_{FeCl3}}{n_{CuCl2}}=\frac{2n_{Fe2O3}}{n_{CuO}}=\frac{1}{2}\)
\(\Rightarrow\frac{n_{Fe2O3}}{n_{CuO}}=\frac{1}{2}\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{CuO}=\frac{80.3}{80.2+160}=50\%\\\%m_{Fe2O3}=100\%-50\%=50\%\end{matrix}\right.\)

b>
Giả sử mỗi chất đều có khối lượng là 1 gam
nKMnO4=0,00633mol
nKClO3=0,00816mol
nMnO2=0,0115mol
nK2Cr2O7=0,0034mol
Các phản ứng :
2KMnO4 + 16HCl -> 2KCl + 2MnCl2 + 5Cl2 + 8H2O
0,00663 --------------------------- →0,0158
KClO3 + 6HCl -> KCl + 3Cl2 + 3H2O
0,00816 -------------- → 0,0245
MnO2 + 4HCl -> MnCl2 + Cl2 + 2H2O
0,0115------------------- → 0,0115
K2Cr2O7 + 14HCl -> 2KCl + 2CrCl3 + 3Cl2 + 7H2O
0,0034 ---------------------------------- →0,0102
=> Chất cho lượng khí lớn nhất là Cl2 : KClO3.

Câu 3: M giải qua rồi nên t giải tắt cho lẹ :D
Thích để phân số thì t làm phân số vậy (:
\(MnO_2\left(0,02\right)+4HCl\left(đăc\right)\rightarrow MnCl_2+Cl_2\left(0,02\right)+4H_2O\)
nMnO2 = 0,02 (MOL) => nCl2 = 0,02 (mol)
\(Fe\left(a\right)+H_2SO_4\rightarrow FeSO_4+H_2\left(a\right)\)
Gọi a là số mol Fe phản ứng
Theo đề => \(56a-2a=167,4\)
\(\Rightarrow a=3,1\left(mol\right)\)=> nH2 = 3,1 (mol)
Đun nóng hoàn toàn X thì:
\(2KClO_3-t^o->2KCl+3O_2\)
=> Chất rắn còn lại là MnO2 và KCl không bị nhiệt phân
Ta có: \(\left\{{}\begin{matrix}m_{MnO_2}=3\\m_{KCl}+m_{KClO_3}=197\\m_{MnO2}+m_{KCl}=152\end{matrix}\right.\)\(\Rightarrow\left\{{}\begin{matrix}m_{MnO_2}=3\left(g\right)\\m_{KCl}=149\left(g\right)\\m_{KClO_3}=48\left(g\right)\end{matrix}\right.\)
\(\Rightarrow n_{KClO_3}=\dfrac{96}{245}\left(mol\right)\)
=> \(n_{O_2}=\dfrac{144}{245}\left(mol\right)\)
* Thí nghiệm 4:
\(O_2\left(\dfrac{144}{245}\right)+2H_2\left(\dfrac{288}{245}\right)-t^o->2H_2O\left(\dfrac{288}{245}\right)\)
\(H_2\left(0,02\right)+Cl_2\left(0,02\right)-t^o->2HCl\left(0,04\right)\)
Dung dịch Y: HCl
=> nHCl = 0,04 (mol) => mHCl = 1,46 (g)
nH2O = \(\dfrac{288}{245}\) (mol) => mH2O = \(\dfrac{5184}{245}\) (g)
\(\Rightarrow C\%_{HCl}=\dfrac{1,46.100}{\dfrac{5184}{245}+1,46}=6,45\%\)
Câu 1:
A, B lần lượt là kim loại kiềm, kiềm thổ
\(2A\left(a\right)+2HCl\rightarrow2ACl+H_2\left(0,5a\right)\)\(\left(1\right)\)
\(B\left(b\right)+2HCl\rightarrow BCl_2+H_2\left(b\right)\)\(\left(2\right)\)
\(n_{HCl}=0,5\left(mol\right)\)
\(n_{H_2}=0,78\left(mol\right)\)
Gỉa sử lượng HCl tham gia phản nứng hết
=> nH2 = 1/2nHCl = 0,25 (mol) < 0,78 (mol)
=> A, B còn dư tác dụng với nước có trong dung dịch HCl
\(2A\left(1,25x-a\right)+2H_2O\rightarrow2AOH+H_2\left(0,625x-0,5a\right)\)\(\left(3\right)\)
\(B\left(x-b\right)+2H_2O\rightarrow B\left(OH\right)_2+H_2\left(x-b\right)\)\(\left(4\right)\)
Ta có: \(nA:nB=5:4\)
Gọi x là số mol của B => nA = 1,25x (mol)
\(\Rightarrow1,25xA+xB=42,6\left(I\right)\)
Gọi a, b lần lượt là số mol của A, B ở pt (1) và (2)
Ta có: \(\sum n_{H_2}=0,78=0,5a+b+0,625x+x\)
\(\Leftrightarrow x=0,48\left(mol\right)\)
Thay vào (I) \(\Leftrightarrow0,6A+0,48B=42,6\)
- Vói A = 7 (Li) => B = 80 (loại)
- Với A = 23 (Na) => B = 60 (loại)
- Với A = 39 (K) => B = 40 (Ca) thoã mãn
- A = 85 (Rb) = > B = -17,5 (loại)
- A = 133 (Cs) => B = -77,5 (loại)
- A = 223 (Fr) = > B = -290 (loại)
Vậy A: K,
B: Ca

Câu 1: Cho các phản ứng:
Fe2O3 +HCl →
F2 + H2O to →
KMnO4 + HCl (đặc) →
NaCl + H2O đp có màng ngăn →
Trong các phản ứng trên, những phản ứng tạo ra đơn chất là
A. (1), (2), (3)
B. (1), (3), (4)
C. (2), (3), (4)
D. (1), (2), (4)
Câu 2: Phát biểu nào sau đây đúng?
A. Clorua vôi là muối tạo bởi một kim loại liên kết với một loại gốc axit.
B. Clorua vôi là muối tạo bởi một kim loại liên kết với hai loại gốc axit.
C. Clorua vôi là muối tạo bởi hai kim loại liên kết với một loại gốc axit.
D. Clorua vôi không phải là muối.
Câu 3: Phát biểu nào sau đây đúng?
A. Dung dịch HF được đựng trong lọ bằng thủy tinh.
B. Cl2 có tính oxi hóa mạnh, oxi hóa được H2O ở nhiệt độ thường.
C. HF là chất khí, tan nhiều trong nước tạo ra dung dịch axit mạnh.
D. HCl là chất khí, tan nhiều trong nước tạo ra dung dịch axit mạnh.
Câu 4: Dãy chất nào trong các dãy sau đây gồm các chất đều tác dụng được với dung dịch HCl ở điều kiện thường?
A. Al, CuO, Na2SO4
B. Zn, Ag, CaCO3
C. Mg, MgO, AgNO3
D. Fe, Cu(OH)2, NaNO3
Câu 5: Thực hiện các thí nghiệm sau:
Sục khí Cl2 vào dung dịchCa(OH)2
Cho nước Br2 vào dung dịch KI
Cho KMnO4 vào dung dịchHCl đặc, nóng
Cho Na2CO3 vào dung dịch HCl
Trong các thí nghiệm trên, số thí nghiệm có phản ứng oxi hóa – khử xảy ra là
A. 1 B. 2 C. 3 D. 4
Câu 1: Cho các phản ứng:
Fe2O3 +HCl →
F2 + H2O to →
KMnO4 + HCl (đặc) →
NaCl + H2O đp có màng ngăn →
Trong các phản ứng trên, những phản ứng tạo ra đơn chất là
A. (1), (2), (3)
B. (1), (3), (4)
C. (2), (3), (4)
D. (1), (2), (4)
Câu 2: Phát biểu nào sau đây đúng?
A. Clorua vôi là muối tạo bởi một kim loại liên kết với một loại gốc axit.
B. Clorua vôi là muối tạo bởi một kim loại liên kết với hai loại gốc axit.
C. Clorua vôi là muối tạo bởi hai kim loại liên kết với một loại gốc axit.
D. Clorua vôi không phải là muối.
Câu 3: Phát biểu nào sau đây đúng?
A. Dung dịch HF được đựng trong lọ bằng thủy tinh.
B. Cl2 có tính oxi hóa mạnh, oxi hóa được H2O ở nhiệt độ thường.
C. HF là chất khí, tan nhiều trong nước tạo ra dung dịch axit mạnh.
D. HCl là chất khí, tan nhiều trong nước tạo ra dung dịch axit mạnh.
Câu 4: Dãy chất nào trong các dãy sau đây gồm các chất đều tác dụng được với dung dịch HCl ở điều kiện thường?
A. Al, CuO, Na2SO4
B. Zn, Ag, CaCO3
C. Mg, MgO, AgNO3
D. Fe, Cu(OH)2, NaNO3
Câu 5: Thực hiện các thí nghiệm sau:
Sục khí Cl2 vào dung dịchCa(OH)2
Cho nước Br2 vào dung dịch KI
Cho KMnO4 vào dung dịchHCl đặc, nóng
Cho Na2CO3 vào dung dịch HCl
Trong các thí nghiệm trên, số thí nghiệm có phản ứng oxi hóa – khử xảy ra là
A. 1 B. 2 C. 3 D. 4

9): n(CO2) = 4,48/22,4 = 0,2mol
Số mol mỗi chất trong hỗn hợp dung dịch ban đầu:
n(Na2CO3) = 0,5.0,2 = 0,1mol; n(NaOH) = 0,75.0,2 = 0,15mol
Khi cho CO2 vào dung dịch chứa Na2CO3 và NaOH thứ tự các phản ứng xảy ra:
2NaOH + CO2 → Na2CO3 + H2O
0,15 0,075 0,075
CO2 + Na2CO3 + H2O → 2NaHCO3
0,125 0,125 0,25
Số mol Na2CO3 có trong dung dịch X:
n(Na2CO3) = 0,1 + 0,075 - 0,125 = 0,05mol
Cho dung dịch BaCl2 dư vào dung dịch X:
Na2CO3 + BaCl2 → BaCO3 + 2NaCl
0,05 0,05
Khối lượng kết tủa thu được: m(BaCO3) = 0,05.197 = 9,85gam
1) Dung dịch A chứa CO32- (x mol) và HCO3- (y mol)
CO32- + H+ —> HCO3-
x…………x………….x
HCO3- + H+ —> CO2 + H2O
x+y…….0,15-x
Dung dịch B tạo kết tủa với Ba(OH)2 nên HCO3- dư, vậy nCO2 = 0,15 – x = 0,045 —> x = 0,105
HCO3- + OH- + Ba2+ —> BaCO3 + H2O
—> nBaCO3 = (x + y) – (0,15 – x) = 0,15 —> y = 0,09
—> m = 20,13 gam