Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

bn j ơi, Hiền lương gửi vào lúc nào mak bh ms trả lời hả bn

ib add fb đi , tui chụp gửi qua cho
có đáp án hộ cậu , đề trường mẹ tui !!

Phùng_ Xuân_ Quỳnh bao giờ bạn kiểm tra thế. Bài mấy là lớp bạn kiểm tra 15p, 45p thế?

A/ Phần trắc nghiệm: (3đ)
Câu1 (1đ) Chọn các từ thích hợp trong các từ sau để điền vào chỗ trống cho hoàn chỉnh câu:
Hoá trị, kí hiệu hoá học, nguyên tử, phân tử, nhóm nguyên tử, đơn chất, hợp chất.
..........................là con số biểu thị khả năng liên kết của nguyên tử hay................ với nguyên tử của nguyên tố khác.
b) Công thức hoá học của ........................chỉ gồm một................
Câu2: (2đ): Em hãy khoanh tròn vào A, B,C hay D ở phương án nào em cho là đúng trong các phương án sau:
a) Hoá trị của S, nhóm PO4 trong các công thức hóa học sau: H2S & H3PO4 lần lượt là:
A.III,II B.I,III C.III,I D.II,III
b)Trong các hợp chất có CTHH sau: HCl, H2, NaOH, KMnO4, O2, NaClO. Số chất hợp chất có là:
A.1 B.2 C.3 D.4
c) Công thức hoá học phù hợp Si(IV) là:
A.Si4O2 B.SiO2 C.Si2O2 D.Si2O4
d) Dựa theo hóa trị của Fe trong hợp chất có CTHH là FeO. CTHH phù hợp với hóa trị của Fe:
A.FeSO4 B.Fe2SO4 C.Fe2(SO4)2 D.Fe2(SO4)3
e) Cho biết CTHH của X với H là H3X, của Y với O là YO. Chọn CTHH nào đúng cho hợp chất X và Y:
A.XY3 B.X3Y C.X2Y3 D.X2Y2
f) Khối lượng tính bằng đvC của 4 phân tử đồng II clo rua CuCl2 là:
A.540 B.542 C.544 D.548
B/ Phần tự luận (7đ)
Câu 1 (2đ) Viết CTHH của các chất sau và tính phân tử khối của chất đó
a) Khí oxi biết phân tử có 2O
b) Axit sunfuric có phân tử gồm 2H, 1S và 4O
Câu 2 (2đ) a) Tìm hóa trị của Mn trong hợp chất Mn2O7
b) Lập CTHH của Al và nhóm SO4
Câu 3: (1,75đ) Cho Công thức hoá học của Natricacbonat Na2CO3. Hãy nêu các ý biết được về chất này?
Câu 4: (1,25đ) Hợp chất A có phân tử gồm 2 nguyên tử X & 3 nguyên tử Y. Tỉ lệ khối lượng của X &Y là 7: 3. Phân tử khối của hợp chất là 160. Hỏi
a) Nguyên tố X,Y là nguyên tố nào?
b) Viết CTHH của hợp chất A?
Cho biết Cu= 64, Cl=35,5, O=16, S=32, H=1, Na=23, C=12
Đáp án đề kiểm tra 1 tiết môn Hóa học lớp 8A/ Phần trắc nghiệm: (3đ)
Câu 1:
a) Hoá trị, nhóm nguyên tử (0,5đ)
b) đơn chất, kí hiệu hoá học (0,5đ)
Câu 2:
a) D đúng (0,5đ)
b) D đúng (0,5đ)
c) B đúng (0,25đ)
d) A đúng (0,25đ)
e) C đúng (0,25đ)
f) A đúng (0,25đ)
B/ Phần tự luận (7đ)
Câu 1:
a) O2 (0,5đ) PTK bằng 2,16=32 (0,5đ)
b) H2SO4 (0.5đ), PTK: 98 (0,5đ)
Câu 2
a) Gọi a là hóa trị của Mn (0,25đ)
Theo quy tắc hóa trị ta có: 2.a =7.II (0,25đ)
=> a= 7
Vậy hóa trị của Mn là VII (0,25đ)
b) Viết công thức tổng quát: Alx(SO4)y (0,25đ)
Theo quy tắc hoá trị ta có: III. x = II. Y (0,25đ)
x : y = 2: 3 (0,25đ)
Vậy x=2 & y = 3 (0,25đ)
CTHH là Al2(SO4)3 (0,25đ)
Câu 3:
Natricacbonat do 3 nguyên tố: Na, C & O tạo nên (0,5đ)
Có 2Na, 1 C & 3O trong phân tử (0,5đ)
PTK: 23.2 + 12+ 16.3 = 106 (0,75đ)
Câu 4: Khối lượng của X: là 160: 10 . 7 = 112 (0,25đ)
Khối lượng của Y là 16 . 3 = 48 (0,25đ)
NTK của X là 112:2: = 56
NTK của Y là 48: 3 =16 (0,25đ)
Vậy X là Fe, Y là O (0,25đ)
CTHH Fe2O3 (0,25đ)

ĐỀ BÀI
Phần I: Trắc nghiệm khách quan. ( 4 điểm)
Hãy khoanh tròn vào một trong các chữ cái A, B, C hoặc D đứng trước câu trả lời đúng nhất
Cho các hiện tượng:
1. Hòa tan muối ăn vào nước được nước muối.
2. Khi đánh diêm có lửa bắt cháy.
3. Thanh đồng được kéo thành sợi nhỏ để làm dây điện.
4. Thuỷ tinh được đun nóng chảy ở to cao rồi thổi thành bóng đèn, lọ hoa, cốc …
5. Cho 1 mẫu đá vôi vào giấm ăn thấy có bọt khí thoát ra.
Câu 1: Hiện tượng vật lí là
A. 1, 3 và 4 B. 1 và 2
C. 2 và 3 D. 2 và 5
Câu 2: Hiện tượng hóa học là
A. 1, 3 và 4 B. 1 và 2
C. 2 và 3 D. 2 và 5
Câu 3: Phát biểu đúng là
A. Làm muối từ nước biển là sự biến đổi hóa học.
B. Thức ăn bị ôi thiu là sự biến đổi vật lí.
C. Nung đá vôi là sự biến đổi hóa học.
D. Cồn để trong lọ không kín bị bay hơi là sự biến đổi hóa học.
Câu 4: Cho quá trình sau:
Giai đoạn có sự biến đổi hóa học là
A. I B. II C. III D. IV
Câu 5: Phát biểu sai là
A. Trong 1 PƯHH, tổng khối lượng các chất sản phẩm bằng tổng khối lượng các chất tham gia.
B. Trong 1 PƯHH, số phân tử của các chất được bảo toàn.
C. Trong 1 PƯHH, số nguyên tử của mỗi nguyên tố được bảo toàn.
D. Trong 1 PƯHH có n chất nếu biết khối lượng của (n-1) chất thì tính được khối lượng của chất còn lại.
Câu 6: Lưu huỳnh cháy theo sơ đồ phản ứng sau: Lưu huỳnh + khí oxi → khí sunfurơ. Nếu đã có 48g lưu huỳnh cháy và thu được 96g khí sunfurơ thì khối lượng oxi đã tham gia phản ứng là
A. 40g B. 44g C. 48g D. 52g
Câu 7: Thủy ngân oxit bị phân huỷ theo sơ đồ sau:
Thuỷ ngân oxit → Thuỷ ngân + Oxi. Khi phân huỷ
2,17g thuỷ ngân oxit thu được 0,16g oxi. Khối lượng thuỷ ngân thu được trong thí nghiệm này là
A. 2g B. 2,01g C. 2,02g D. 2,05g
Câu 8: Một cốc đựng dung dịch axit clohidric và 1 viên kẽm được đặt ở đĩa cân A. Trên đĩa cân B đặt các quả
cân sao cho kim cân ở vị trí cân bằng. Bỏ viên kẽm vào cốc axit. Biết rằng có phản ứng:
Kẽm + axit clohidric → Kẽm clorua + khí hidro. Vị trí của kim cân là
A. Kim cân lệch về phía đĩa cân A. B. Kim cân lệch về phía đĩa cân B.
C. Kim cân ở vị trí thăng bằng. D. Kim cân không xác định.
Câu 9: Khí Nitơ và khí Hidro tác dụng với nhau tạo ra Amoniac (NH3). PTHH viết đúng là
A. N + 3H → NH3 B. N2 + H2 → NH3
C. N2 + H2 →2NH3 D. N2 + 3H2 → 2NH3
Câu 10: PTHH cho biết chính xác
A. Số nguyên tử, phân tử của các chất tham gia phản ứng.
B. Tỉ lệ số phân tử (nguyên tử) của các chất trong phản ứng.
C. Khối lượng của các chất phản ứng.
D. Nguyên tố nào tạo ra chất.
Câu 11: Phản ứng giữa Fe2O3 và CO được biểu diễn như sau:
xFe2O3 + yCO → 2Fe + 3CO2.
Các giá trị của x và y cho phương trình cân bằng là
A. x = 1; y = 1 B. x = 2 ; y = 1 C. x = 1 ; y = 3 D. x = 3 ; y = 1
Câu 12: Cho PTHH: 2Cu + O2 → 2CuO. Tỉ lệ giữa số nguyên tử đồng: số phân tử oxi: số phân tử CuO là
A. 1:2:1 B. 2:1:1 C. 2:1:2 D. 2:2:1
Câu 13: Trong phản ứng hóa học, phân tử này biến đổi thành phân tử khác là do
A. Các nguyên tử tác dụng với nhau.
B. Các nguyên tố tác dụng với nhau.
C. Liên kết giữa các nguyên tử không bị thay đổi.
D. liên kết giữa các nguyên tử thay đổi.
Câu 14: Trong một phản ứng hóa học, các chất phản ứng và chất tạo thành phải chứa cùng
A. Số nguyên tử của mỗi nguyên tố. B. Số nguyên tử trong mỗi chất.
C. Số phân tử của mỗi chất. D. Số nguyên tố tạo ra chất.
Câu 15: Có phát biểu: “Trong PƯHH chỉ xảy ra sự thay đổi liên kết giữa các nguyên tử (1), nên tổng khối lượng các chất được bảo toàn (2)’’. Trong đó
A. (1) đúng, (2) sai.
B. cả 2 ý trên đều đúng và ý (1) giải thích cho ý (2).
C. (1) sai, (2) đúng.
D. cả 2 ý trên đều đúng và ý (2) giải thích cho ý (1).
Câu 16: Phương trình hóa học dùng để
A. Biểu diễn PƯHH bằng chữ.
B. Biểu diễn ngắn gọn PƯHH bằng công thức hoá học.
C. Biểu diễn sự biến đổi của từng chất riêng rẽ.
D. Biểu diễn sự biến đổi của các nguyên tử trong phân tử.
Phần 2: Tự luận (6 điểm)
Câu 17. Lập PTHH của các phản ứng sau, cho biết tỉ lệ số nguyên tử, phân tử của các chất trong mỗi phản ứng
a. Mg + HCl → MgCl2 + H2
b. Fe2O3 + CO → Fe + CO2
c. Al + H2SO4 → Al2(SO4)3 + H2
d. Al + Cl2 → AlCl3
Câu 18. Cho 8,4g bột sắt cháy hết trong 3,2g khí oxi (đktc) tạo ra oxit sắt từ (Fe3O4).
a. Viết PTHH của phản ứng và cho biết tỉ lệ số nguyên tử, phân tử của các chất trong phản ứng.
b. Tính khối lượng oxit sắt từ tạo thành.
Câu 19 . Nếu để một thanh sắt ngoài trời thì sau một thời gian khối lượng thanh sắt sẽ nhỏ hơn, lớn hơn hay bằng khối lượng ban đầu? Hãy giải thích.
ĐÁP ÁN VÀ THANG ĐIỂM
Phần I. Trắc nghiệm khách quan. (4 điểm)
Mỗi lựa chọn đúng đạt 0,25 điểm
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
A
D
C
D
B
C
B
B
D
B
C
C
D
A
B
B
Phần II. Tự luận (6 điểm)
Câu
Đáp án
Điểm
Câu 1
(3 điểm)
a. Mg + 2HCl → MgCl2 + H2
0,5đ
Số nguyên tử Mg : số phân tử HCl : số phân tử MgCl2 : số phân tử H2 = 1:2:1:1
0,25
b. Fe2O3 + 3CO → 2Fe + 3CO2
0,5đ
Số phân tử Fe2O3 : số phân tử CO : số nguyên tử Fe : số phân tử CO2 = 1:3:2:3
0,25
c. 2Al + 3H2SO4 → Al2(SO4)3 + 3H2
0,5đ
Số nguyên tử Al : số phân tử H2SO4 : số phân tử Al2(SO4)3 : số phân tử H2 = 2:3:1:3
0,25
d. 2Al + 3Cl2 → 2AlCl3.
Số nguyên tử Al : số nguyên tử Cl2 : số phân tử AlCl3 = 2:3:2
0,5đ
0,25
Câu 2
(2 điểm)
3Fe + 2O2 → Fe3O4
Số nguyên tử Fe : số nguyên tử O2 : số phân tử Fe3O4 = 3:2:1
- Áp dụng ĐLBTKL ta có: m Fe + m O2 = m Fe3O4 = 8,4 + 3,2 =11, 6 gam
0,5đ
0,5đ
1 đ
Câu 3
(1,0 điểm)
- Thanh sắt sẽ tăng khối lượng vì có phải ứng với oxi trong không khí.

1. Phân biệt các dung dịch đựng trong các lọ mất nhãn sau:
H2O, HCl, MgCl2, Mg(NO3)2, KOH
Bạn nào có đề kiểm tra một tiết hóa học 8 chương một không cho mình xin với ( có giải càng tốt nhé )


I. Trắc nghiệm khách quan (4 điểm)
Hãy khoanh tròn một trong các chữ A, B, C, D trước phương án chọn đúng.
Câu 1. Hãy chọn câu phát biểu đúng .
A. Nguyên tử là những hạt vô cùng nhỏ gồm proton mang điện tích dương và các electron mang điện tích âm.
B. Nguyên tử là những hạt vô cùng nhỏ, trung hòa về điện. Nguyên tử gồm hạt nhân mang điện tích dương và vỏ nguyên tử tạo bởi các electron mang điện tích âm.
C. Hạt nhân nguyên tử gồm các hạt proton, notron, electron.
D. Trong mỗi nguyên tử số proton bằng số electron cộng với số notron.
Câu 2. Cho các chất có công thức hóa học như sau:
1. O2 5. SO2
2. O3 6. N2
3. CO2 7. H2O
4. Fe2O3
Nhóm chỉ gồm các hợp chất là:
A. 1 , 3 , 5 , 7 B. 2 , 4 , 6 , 5
C. 2 , 3 , 5 , 6 D. 3 , 4 , 5 , 7
Câu 3. Một bình chứa hỗn hợp khí X gồm 1,12 lit khí oxi và 2,24 lít khí cacbonđioxit ở đktc. Tổng số mol các khí trong hỗn hợp khí X là:
A. 0,25 B. 0,5 C. 0,15 D. 0,20
Câu 4. Công thức hóa học hợp chất của nguyên tố X với nhóm SO4 có hóa trị II là X2(SO4)3. Công thức hóa học hợp chất của nguyên tố Y với hiđro là H3Y.
Công thức hóa học hợp chất của nguyên tố X và nguyên tố Y là:
A . XY2 B. XY3 C. XY D. X2Y3
Câu 5. Đốt cháy hoàn toàn 12,8g đồng (Cu) trong bình chứa oxi (O2) thu được 16 gam đồng (II) oxit (CuO). Khối lượng oxi đã tham gia phản ứng là
A. 6,40 gam B. 4,80 gam.
C. 3,20 gam D. 1,67 gam.
(cho Cu = 64 , O = 16).
Câu 6. Khối lượng của 0,5mol Mg và 0,3mol CO2 tương ứng là
A. 10 gam Mg; 12 gam CO2
B. 13 gam Mg; 15 gam CO2
C. 12 gam Mg; 13,2 gam CO2
D. 14 gam Mg; 14,5 gam CO2
(cho Mg = 24 , O = 16 , C = 12).
Câu 7. Hãy điền các hệ số vào trước công thức hóa học của các chất thích hợp để được các phương trình hóa học đúng.
1. ..... Al + .......H2SO4 → Al2(SO4)3 + ..... H2
2. ..... P + ....... O2 → ..... P2O5
Câu 8. Thể tích của hỗn hợp khí gồm 0,5 mol CO2, và 0,2 mol O2 ở điều kiện tiêu chuẩn là
A. 11, 2 lit B. 22,4 lit C. 4,48 lit D. 15,68 lit
II. Tự luận (6 điểm)
Câu 9. (1.5 điểm)
1. Tính khối lượng của một hỗn hợp khí ở đktc gồm 2,24 lit SO2 và 3,36 lit O2
2. Tính thể tích ở đktc của một hỗn hợp khí gồm 4,4 gam CO2 và 3,2 gam O2
3. Tính số mol chứa trong 3.10 23 phân tử nước.
Câu 10. (4,5 điểm)
Phản ứng hóa học xảy ra khi cồn cháy ( đèn cồn trong phòng thí nghiệm) là: Rượu etylic (C2H5OH) + oxi → Cacbonnic (CO2) + Nước
1. Hãy lập phương trình hóa học của phản ứng.
2. Cho biết tỷ lệ số phân tử của các chất trong phản ứng hóa học.
3. Tính tỷ lệ về khối lượng giữa các chất trong phản ứng hóa học.
4. Tính thể tích khí oxi cần thiết để đốt cháy hết 4,6 gam rượu etylic và thể tích khí cacbonic tạo thành ở điều kiện tiêu chuẩn.
(Cho biết: S = 32 ; C = 12 O = 16 ; H = 1)
Câu 1 (2,0 điểm)
a) Hãy cho biết thế nào là đơn chất? Hợp chất?
b) Trong số các công thức hóa học sau: CO2, O2, Zn, CaCO3, công thức nào là công thức của đơn chất? Công thức nào là công thức của hợp chất?
Câu 2 (1,0 điểm): Lập công thức hóa học và tính phân tử khối của:
a) Fe (III) và O.
b) Cu (II) và PO4 (III).
Câu 3 (3,0 điểm)
a) Thế nào là phản ứng hóa học? Làm thế nào để biết có phản ứng hóa học xảy ra?
b) Hoàn thành các phương trình hóa học cho các sơ đồ sau:
Al + O2 ![]() Al2O3
Al2O3
Na3PO4 + CaCl2 → Ca3(PO4)2 + NaCl
Câu 4 (2,0 điểm)
a) Viết công thức tính khối lượng chất, thể tích chất khí (đktc) theo số mol chất.
b) Hãy tính khối lượng và thể tích (đktc) của 0,25 mol khí NO2.
Câu 5 (1,0 điểm): Xác định công thức hóa học của hợp chất tạo bởi 40% S, 60% O. Khối lượng mol của hợp chất là 80 gam.
Câu 6 (1,0 điểm): Khi đốt dây sắt, sắt phản ứng cháy với oxi theo phương trình:
3Fe + 2O2 ![]() Fe3O4
Fe3O4
Tính thể tích khí O2 (đktc) cần dùng để phản ứng hoàn toàn với 16,8 gam Fe.
(Cho: Fe = 56; Cu = 64; P = 31; O = 16; N = 14; O = 16)
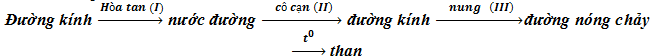
Đề kiểm tra 1 tiết Hóa học 8 Chương 2
Câu 1 : Đốt cháy hoàn toàn m gam chất X dung 4,48 lít O2 (đktc) thu được 2,24 lít CO2 (đktc) và 3,6 gam H2O. Xác định khối lượng chất X đem dùng.
Câu 2 : Cho hỗn hợp hai muối X2SO4 và YSO4 có khối lượng 22,1 gam tác dụng vừa đủ với dung dịch chứa 31,2 gam BaCl2, thu được 34,95 gam kết tủa BaSO4. Tính khối lượng hai muối tan thu được.
Câu 3 : Cho 20 gam sắt III sunfat Fe2(SO4)3 tác dụng với natri hidroxit NaOH, thu được 10,7 gam sắt III hidroxit Fe(OH)3 và 21,3 gam natri sunfat Na2SO4. Xác định khối lượng natri hidroxit tham gia vào phản ứng.
Câu 4 : Cho sơ đồ phản ứng sau :
Lập phương trình hóa học của các phản ứng trên.
Câu 5 : Chọn những từ hoặc cụm từ thích hợp điền vào chỗ trống:
____ là quá trình biến đổi chất này thành chất khác. Chất biến đổi trong phản ứng gọi là ____, còn ____ mới sinh ra gọi là ____ Trong quá trình phản ứng, lượng chất ____. giảm dần, còn lượng chất ____ tăng dần.
Câu 6 : Hòa tan hoàn toàn 6,5 gam kẽm vào dung dịch axit clohidric HCl có chứa 7,3 gam HCl (vừa đủ). Sau phản ứng thu được dung dịch muối kẽm clorua và 0,2 gam khí hidro,
Viết phản ứng hóa học xảy ra.
Tính khối lượng kẽm clorua ZnCl2 tào thành.
bn lm được thì lm dùm mk lun nha