Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi công thức phân tử chung của oxit là \(Fe_xO_y\).
Khối lượng mol của oxit sắt là \(160\left(g/mol\right)\Rightarrow56x+16y=160\left(1\right)\).
Thành phần khối lượng sắt trong oxit là \(70\%\)
\(\Rightarrow\dfrac{56x}{160}=70\%\Rightarrow x=2\). Thay vào (1) ta được \(y=3\).
Vậy : CTHH của oxit là \(Fe_2O_3\) (Sắt (III) oxit).

công thức của oxit sắt là: FexOy
M(Fe)= 160*70/100 = 112 =>x= 112/56= 2
M(O)= 160-112= 48 => y= 48/16= 3
Vậy ta có công thức là: Fe2O3

Gọi CTTQ : FexOy (x,y: nguyên, dương)
mFe= 70% . 160=112 => x=nFe=112/56=2
mO=160-112=48 -> y=nO=48/16=3
Với x=2;y=3 -> CTHH oxit sắt: Fe2O3

Đặt công thức của oxit kim loại là MxOy
%mO = 100% - 70% = 30%
⇒ mO = 12y = 160.30% = 48
⇒ y = 3
mM = 160.70% = 112g = M.x (với M là phân tử khối của kim loại M)
Áp dụng quy tắc hóa trị ta có:
a.x = 2.3 = 6 (với a là hóa trị của M; a = 1; 2; 3)
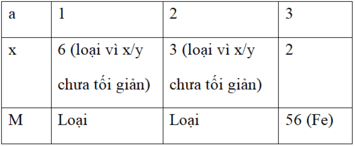
⇒ M là kim loại Sắt.
Vậy công thức hóa học của oxit kim loại là Fe2O3 (Sắt (III) oxit).

Khối lượng của kim loại có trong oxit kim loại:
MKL = 112 g
Khối lượng nguyên tố oxi: mO = 160 – 112 = 48g
Đặt công thức hóa học của oxit kim loại là MxOy, ta có:
MKL. x = 112 => nếu x = 2 thì M = 56. Vậy M là Fe
16y = 48 => y = 3
Vậy CTHH: Fe2O3, đó là sắt (III) oxit
Gọi Công thức hóa học của oxit đó là : MxOy
Ta có : khối lượng của M trong 1 mol là : 160 . 70 : 100 = 112(g)
=> khối lượng của Oxi trong 1 mol là : 160 - 112 = 48(g)
=> số nguyên tử Oxi có trong 1 phân tử Oxit là : 48 : 16 = 3 (nguyên tử)
=>y = 3 => M có hóa trị là III
Ta có : III . x = 3 . II
=> x = 2
=> MxOy = M2O3
=> Mkim loại M là 112 : 2 = 56 (g/mol)
=> M = Fe
Vậy tên Oxit đó là : Fe2O3

Khối lượng của các nguyên tố trong hợp chất là:
\(m_{FE}=\dfrac{70.160}{100}=112\left(g\right)\)
\(m_O=\dfrac{30.160}{100}=48\left(g\right)\)
Số mol có trong mỗi nguyên tố là:
\(n_{FE}=\dfrac{m_{FE}}{M_{FE}}=\dfrac{112}{56}=2\left(mol\right)\)
\(n_O=\dfrac{m_O}{M_O}=\dfrac{48}{16}=3\left(mol\right)\)
Vậy hợp chất có 2 nguyên tử Fe, 3 nguyên tử O
Công thức hóa học của hợp chất là: \(FE_2O_3\)

\(m_{O_{ }}=\dfrac{160.30\%}{100\%}=48\left(g\right)\)
\(=>n_{O_{ }}=\dfrac{48}{16}=3\left(mol\right)\)
\(m_{Fe}=160-48=112\left(g\right)\)
\(=>n_{Fe}=\dfrac{112}{56}=2\left(mol\right)\)
\(=>CTHH:Fe_2O_3\)

Lập CTHH và nêu ý nghĩa của cac hợp chất
Khi bt thành pần % nguyên tố và khối lượng mol ,tỉ lệ khối lượng
-Sắt oxit biết sắt chiếm 70% và õi chiếm 30% và khối lượng mol 160g
\(m_{Fe}=\dfrac{70\%.160}{100}=112\left(g\right)\Rightarrow n_{Fe}=\dfrac{m}{M}=\dfrac{112}{56}=2\left(mol\right)\)
\(m_O=\dfrac{30\%.160}{100}=48\left(g\right)\Rightarrow n_O=\dfrac{m}{M}=\dfrac{48}{16}=3\left(mol\right)\)
\(\Rightarrow CTHH:Fe_2O_3\)
-Hợp chất A gồm 2 ngto là C và O tỉ lệ khối lượng của C và O là mC : mO = 3:8
Gọi CTHH của hợp chất A là \(C_xO_y\) ( x,y là nhg số nguyên dương đơn giản )
Ta có :
\(\dfrac{m_C}{m_O}=\dfrac{12x}{16y}=\dfrac{3}{8}\Rightarrow\dfrac{x}{y}=\dfrac{3}{8}:\dfrac{12}{16}=\dfrac{1}{2}\)
\(\Rightarrow\left\{{}\begin{matrix}x=1\\y=2\end{matrix}\right.\)
\(\Rightarrow CTHH:CO_2\)
CTTQ: FexOy
x = \(\frac{70\times 160}{56\times 100}=2\)
%O = 100% - 70% = 30%
y = \(\frac{30\times 160}{16\times 100}=3\)
Vậy CTHH: Fe2O3
gọi CT của oxit sắt FexOy ( x;y ∈ N+ )
theo đề bài ta có
%O=30%=>56x/16y = 70/30 => x/y= 2/3 =>x=2 vs y=3
CT : Fe2O3