
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

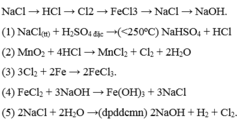

a) Zn+2HCl---->ZnCl2+H2
b) n H2=4,48/22,4=0,2(mol)
n Zn=n ZnCl2=n H2=0,2(mol)
m Zn=0,2.65=13(g)
m Zncl2=0,2.136=27,2(g)
c) CuO+H2---->Cu+H2O
n CuO=24/80=0,3(mol)
--->CuO dư
n CuO=n H2=0,2(mol)
n CuO dư=0,3-0,2=0,1(g)
m CuO dư=0,1.80=8(g)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,2____________0,2____0,2
\(n_{H2}=\frac{4,48}{22,4}=0,2\left(mol\right)\)
\(m_{Zn}=0,2.65=13\left(g\right)\)
\(m_{ZnCl2}=0,2.\left(65+71\right)=27,2\left(g\right)\)
\(PTHH:CuO+H_2\rightarrow Cu+H_2O\)
Ban đầu :0,3____0,2____________
Phứng: 0,2______0,2__________
Sau phứng :0,1___0___________
\(n_{CuO}=\frac{24}{80}=0,3\left(mol\right)\)
Vậy CuO dư
\(m_{CuO_{du}}=0,1.80=8\left(g\right)\)

a) Xét nguyên tố A nguyên tử có 11 p trong hạt nhân.ta thấy lớp 2,3 mỗi lớp có 6p tối đa => nguyên tử nguyên tố A có 3 lớp electron, cụ thể cấu hình e của A là 1s22s22p63s23p5
=> nguyên tố A là Cl
nguyên tử nguyên tố B có cấu hình e :1s22s22p63s23p4 => nguyên tố B là S
Xét nguyên tử nguyên tố D: số hạt mang điện là 16 => 2Z=16 =>Z=8
=> cấu hình e của nguên tử nguyên tố D: 1s22s22d4 => D là nguyên tố Oxi :O
b) S + O2 \(\rightarrow\) SO2 (Lưu huỳnh đi oxit-oxit axit)

1. 1s22s22p63s23p5=> Clo
2. \(\left\{{}\begin{matrix}P+E+N=82\\P+E-N=22\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}2Z+N=82\\2Z-N=22\end{matrix}\right.\)=> Z=26, N=30
=> [Ar]3d64s2
| ↑↓ | ↑ | ↑ | ↑ | ↑ |
3d6
| ↑↓ |
4s2
=> 4 e độc thân

Nguyên tố s là những nguyên tố mà nguyên tử có electron cuối cùng được điền vào phân lớp s.
Nguyên tố p là những nguyên tố mà nguyên tử có electron cuối cùng được điền vào phân lớp p.
Nguyên tố d là những nguyên tố mà nguyên tử có electron cuối cùng được điền vào phân lớp d.
Nguyên tố f là những nguyên tố mà nguyên tử có -electron cuối cùng được điền vào phân lớp f.
Electron hóa trị hay electron ngoài cùng là những electron ở các orbital ngoài cùng và có thể tham gia vào các liên kết của nguyên tử. Electron hóa trị các nguyên tố nhóm chính nằm ở lớp ngoài cùng, trong nguyên tố nhóm phụ (kim loại chuyển tiếp) electron hóa trị có tại lớp ngoài cùng và lớp d kế cận.
bạn nên tìm obitan của mỗi nguyên tố thì sẽ nhanh hơn
Na s=5e,p=6
cL=s=6 e,p=11e
Zn:s=8e,p=12 e
La:s=12e,p=24 e,d=21e ,f=0

Câu 1 :
Ta có : \(Z_X+Z_Y+Z_Z=36\) (1)
Vì X, Y, Z nằm ở 3 nhóm A liên tiếp
⇔ \(\left\{{}\begin{matrix}Z_Y=Z_X+1\\Z_Z=Z_X+2\end{matrix}\right.\)
PT (1) ⇔ \(Z_X+Z_X+1+Z_X+2=36\)
⇔ \(3Z_X=33\)
⇔ \(Z_X\)= 11
⇒ \(Z_Y=11+1=12\)
\(Z_Z=11+2=13\)
Vậy X là Natri (Na), Y là Magie (Mg), Z là Nhôm (Al)
Câu 2 :
X : 2Z +N = 36 ⇔ N= 36 - 2Z
Ta có : 1 ≤ \(\dfrac{N}{Z}\)≤ 1,5
⇔ \(\dfrac{36}{3,5}\le Z\le\dfrac{36}{3}\)
⇔ 10,2 ≤ Z ≤ 12
⇔ Z = 11 , 12
TH1 : Với Z = 11 ⇔ N = 36 - 2 . 11= 14
⇒ A = Z+N = 11+14 = 25 (loại)
TH2 : Với Z =12⇔ N = 36 - 2 . 12 =12
⇒ A = Z+N = 12+12 = 24 (nhận)
⇒ X là Magie (Mg)
Y : 2Z+N = 40 ⇔ N = 40 - 2Z
Ta có : 1≤ \(\dfrac{N}{Z}\)≤ 1,5
⇔ \(\dfrac{40}{3,5}\le Z\le\dfrac{40}{3}\)
⇔ 11,4 ≤ Z≤ 13,3
⇔ Z= 12,13
TH1 : Với Z = 12⇔ N = 40 - 2 . 12= 16
⇒ A = Z+N = 12+16 =28 (loại)
TH2 : Với Z = 13⇔ N = 40 - 2 . 13=14
⇒ A= Z+N = 13+14 = 27 (nhận)
⇒ Y là Nhôm (Al)