Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Tính nX= 0,8 mol; nZ= 0,3 mol; MY= 29 g/mol; MZ= 18,3332 g/mol
MX= \(\dfrac{\text{44.1 + 52.1+40.3+28.2+2.9}}{16}\) = 18,125 g/mol
Các hidrocacbon không no đều có chỉ số H= 4 nên đặt công thức chung là CxH4.
*Phản ứng của X với Ni nung nóng:
CxH4+ y H2 → CxH4+2y (1)
Theo bảo toàn khối lượng ta có: mY= mX= 0,8.18,125= 14,5 gam
→ nY= 14,5 : 29= 0,5 mol
Theo phản ứng (1) thấy số mol khí giảm xuống bằng số mol H2 phản ứng
Vậy nH2 phản ứng= 0,8- 0,5= 0,3 mol
*Phản ứng của Y với dung dịch Br2 dư:
Y gồm Z (C3H8, C2H6, C4H10) và các hidrocacbon không no: CnHm
CnHm+ a Br2 → CnHmBr2a (2)
Khối lượng bình brom tăng lên bằng khối lượng hidrocacbon không no trong Y
Bảo toàn khối lượng ta có: mZ+ mCnHm= mY
Nên mbình brom tăng= mCnHm= mY- mZ= 14,5- 0,3.4.4,5833= 9 gam
Xét cả quá trình thì toàn bộ liên kết kém bền đều bị đứt hết
Đặt công thức chung của H2 phản ứng và Br2 phản ứng là X2.
C4H4+ 3X2 → C4H4X6
C3H4+ 2X2 → C3H4X4
C2H4+ X2 → C2H4X2
Tổng số mol liên kết kém bền trong X là n
Ta có: nX2= 3.nC4H4+ 2.nC3H4 + nC2H4= 3.1+2.3+216.0,8=0,55(mol)
Nên nBr2 pứ= nX2- nH2 pứ= 0,55- 0,3= 0,25 mol

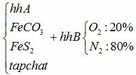
a) Gọi số mol của FeCO3: x (mol) ;
số mol của FeS2: y (mol)
4FeCO3 + O2 → Fe2O3 + 4CO2↑
x → 0,25x → x (mol)
4FeS2 +11O2 → 2Fe2O3 + 8SO2↑
y → 2,75y → 2y (mol)
∑ nO2 = 0,25x + 2,75y (mol)
Cùng điều kiện về nhiệt độ và áp suất nên tỉ lệ về thể tích = tỉ lệ về số mol
=> nN2 = 4nO2 = 4(0,25x + 2,75y)
=> nN2 = x + 11y (mol)
Vậy hỗn hợp Y gồm:
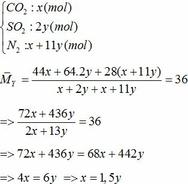
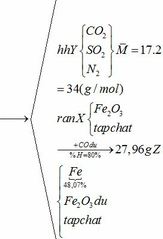
Khối lượng Fe có trong Z là:
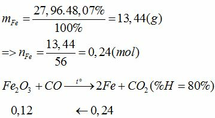
Vì H = 80% => nFe2O3 (trong X) = 0,12. 100% : 80% = 0,15 (mol)
nFe2O3 dư (trong Z) = 0,15 – 0,12 = 0,03 (mol)
Khối lượng tạp chất trong Z = 27,96 – mFe – mFe2O3 dư = 27,96 – 0,24.56 – 0,03.160 = 9,72 (g)
Bảo toàn nguyên tố Fe => nFeCO3 + nFeS2 = 2nFe2O3(trong X)
=> x + y = 0,3 (2)
Từ (1) và (2) => x = 0,18 và y = 0,12 (mol)
Áp dụng công thức PV = nRT ( với n = nCO2 + nSO2 + nN2 = 0,18 + 2. 0,12 + 0,18 +11.0,12 = 1,92)
=> P.10 = 1,92.0,082. (136,5 +273)
=> P = 6,447 ( atm) ≈ 6,5 (atm)
Ta có: mA = mFeCO3 + mFeS2 + mtạp chất = 0,18.116 + 0,12.120 + 9,72 = 45 (g)
![]()
b) hỗn hợp Y gồm:
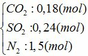
Cho hỗn hợp Y qua O2 ( xúc tác V2O5 ) có phản ứng sau:
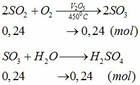
Khối lượng dd sau: mdd sau = mSO3 + mH2O = 0,24. 80 + 592,8 = 612 (g)
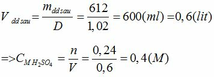

a, Áp suất trong bình không thay đổi vì quá trình đốt cháy lưu huỳnh trong hỗn hợp X là quá trình xảy ra ở áp suất không đổi và sau khi đốt cháy, các sản phẩm khí sinh ra có cùng nhiệt độ và áp suất với hỗn hợp ban đầu.
b,Để tính phần trăm thể tích của hỗn hợp khí Y, ta cần biết tỉ lệ mol của các khí trong hỗn hợp Y. Theo phương trình phản ứng, khi đốt cháy lưu huỳnh trong hỗn hợp X, ta có:
S + O2 → SO2
Vì tỉ lệ mol giữa N2, O2 và SO2 trong hỗn hợp X là 2:1:1 nên khi đốt cháy hết lưu huỳnh, tỉ lệ mol giữa N2 và O2 trong hỗn hợp Y sẽ là 2:5. Do đó, ta có:
Tổng số mol khí trong hỗn hợp Y: 2 + 5 = 7 (vì tỉ lệ mol giữa N2 và O2 là 2:5)
Phần trăm thể tích của hỗn hợp Y: \(d\dfrac{Y}{X}\) = \(\dfrac{V_Y}{V_X}\) = \(\dfrac{n_Y.\dfrac{RT}{P}}{n_X.\dfrac{RT}{P}}=\dfrac{n_Y}{n_X}\) = 7/4 ≈ 175%
Vậy phần trăm thể tích của hỗn hợp khí Y là khoảng 175%.
c, Ta có:
\(d\dfrac{Y}{X}=\dfrac{V_Y}{V_X}=\dfrac{n_Y.\dfrac{RT}{P}}{n_X.\dfrac{RT}{P}}=\dfrac{n_Y}{n_X}\)
Với mỗi mol lưu huỳnh đốt cháy, số mol khí trong hỗn hợp Y tăng thêm 2, do đó nY = nX + 2 nhân số mol lưu huỳnh đốt cháy.
Từ đó suy ra: dY/X = (nX + 2 . số mol lưu huỳnh đốt cháy) / nX = 1 + 2 . số mol lưu huỳnh đốt cháy / nX
Do đó:
1 dY/X 1,21 tương đương với (dY/X) / 1,1684 = 1 + 2 . số mol lưu huỳnh đốt cháy / nX / 1,1684
=> 1,21 / 1,1684 - 1 = 2 . số mol lưu huỳnh đốt cháy / nX
=> số mol lưu huỳnh đốt cháy / nX = 0,0217
=> số mol lưu huỳnh đốt cháy = 0,0217 . nX
Vậy khi lượng lưu huỳnh biến đổi, 1 dY/X tăng thêm 2 . 0,0217 = 0,0434.

Tính % thể tích các khí :
% V C 2 H 2 = 0,448/0,896 x 100% = 50%
% V CH 4 = % V C 2 H 6 = 25%

ban đầu nN2+ nH2=500 và nN2/nH2=1/4
=>nN2=100 mol và nH2=400 mol
N2 + 3H2 ---> 2NH3
ban đầu 100 400 0
phản ứng x 3x 2x
sau phản ứng (100-x ) ( 400-3x) 2x
lại có 50=2x=> x=25 => H%=( 25/100). 100%=25%.

1) N2 + 3H2 ------> 2NH3
x -------> 3x -----------> 2x
theo tỉ lệ đề bài chon n(N2) = 1 mol và n(H2) = 3 mol
gọi x là số mol N2 tham gia pứ
ta có pt đại số theo tỉ khối là:
M(A)/MB) = 0,6 <=> (m/4)/(1 - x + 3 - 3x + 2x) = 0,6 (m: khối lượng của hỗn hợp)
=> x = 0,8
H% = 0,8/1 *100 = 80%
2) ( Bạn đã cho thiếu đề rồi. Bây giờ tôi sẽ thêm vào 10 lit H2)
N2 + 3H2 ------> 2NH3

