Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Giả sử có u (mol) Fe
TN1:
PTHH: Fe + 2HCl --> FeCl2 + H2
u--------------------->u
=> \(n_{H_2}=u\left(mol\right)\)
TN2:
PTHH: 2Fe + 6H2SO4 --> Fe2(SO4)3 + 3SO2 + 6H2O
u------------------------------>1,5u
=> \(n_{SO_2}=1,5u\left(mol\right)\)
Có: \(\dfrac{V_{SO_2}}{V_{H_2}}=\dfrac{n_{SO_2}}{n_{H_2}}=\dfrac{1,5u}{u}=1,5\Rightarrow V_{SO_2}=1,5.3,36=5,04\left(l\right)\)
TN3:
PTHH: Fe + 4HNO3 --> Fe(NO3)3 + NO + 2H2O
u-------------------------->u
=> \(n_{NO}=u\left(mol\right)\)
Có: \(\dfrac{V_{NO}}{V_{H_2}}=\dfrac{n_{NO}}{n_{H_2}}=\dfrac{u}{u}=1\Rightarrow V_{NO}=3,36\left(l\right)\)

SO3 + H2O --------> H2SO4
m/80...m/80...............m/80 (mol)
mct của dd mới = 500.1,2.0,245 + 49m/40 =147 + 49m/40 (g)
mdd mới = 1,2.500 + m = 600 + m (g)
=> (147 + 49m/40 )/(600 + m) = 0,49
=> m= 200(g)

a, \(Fe_3O_4+4H_2SO_4\rightarrow FeSO_4+Fe_2\left(SO_4\right)_3+4H_2O\) (1)
\(Cu+Fe_2\left(SO_4\right)_3\rightarrow CuSO_4+2FeSO_4\) (2)
\(Cu+2H_2SO_{4\left(đ\right)}\underrightarrow{t^o}CuSO_4+SO_2+2H_2O\) (3)
\(2Fe_3O_4+10H_2SO_{4\left(đ\right)}\underrightarrow{t^o}3Fe_2\left(SO_4\right)_3+SO_2+10H_2O\) (4)
\(5SO_2+2KMnO_4+2H_2O\rightarrow2MnSO_4+K_2SO_4+2H_2SO_4\) (5)
b, - K là Fe3O4 dư. → mFe3O4 (dư) = 0,4 (g)
- B gồm: CuSO4, FeSO4 và Fe2(SO4)3.
Gọi: số mol Cu, Fe3O4 pư với H2SO4 loãng lần lượt là: x, y (mol)
⇒ 64x + 232y = 8 - 0,4 (1)
Theo PT: \(\left\{{}\begin{matrix}n_{FeSO_4\left(1\right)}=n_{Fe_2\left(SO_4\right)_3\left(1\right)}=n_{Fe_3O_4}=y\left(mol\right)\\n_{CuSO_4}=n_{Fe_2\left(SO_4\right)_3\left(2\right)}=n_{Cu}=x\left(mol\right)\\n_{FeSO_4\left(2\right)}=2n_{Cu}=2x\left(mol\right)\end{matrix}\right.\)
→ Trong B có: CuSO4: x (mol), FeSO4: y + 2x (mol) và Fe2(SO4)3: y - x (mol)
⇒ 160x + 152(y+2x) + 400(y-x) = 17,2 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,01\left(mol\right)\\y=0,03\left(mol\right)\end{matrix}\right.\)
⇒ mCuSO4 = 0,01.160 =1,6 (g)
mFeSO4 = (0,03+2.0,01).152 = 7,6 (g)
mFe2(SO4)3 = (0,03-0,01).400 = 8 (g)
c, Trong 8 (g) hh có Cu: 0,01 (mol) và Fe3O4: 0,03 + 0,4/232 = 23/725 (mol)
Theo PT: \(n_{SO_2}=n_{Cu}+\dfrac{1}{2}n_{Fe_3O_4}\approx0,026\left(mol\right)\)
\(n_{KMnO_4}=0,04.1=0,04\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{0,026}{5}< \dfrac{0,04}{2}\), ta được KMnO4 dư.
Theo PT: \(\left\{{}\begin{matrix}n_{KMnO_4\left(pư\right)}=n_{MnSO_4}=n_{H_2SO_4}=\dfrac{2}{5}n_{SO_2}=0,0104\left(mol\right)\\n_{K_2SO_4}=\dfrac{1}{5}n_{SO_2}=0,0052\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow n_{KMnO_4\left(dư\right)}=0,04-0,0104=0,0296\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}C_{M_{KMnO_4}\left(dư\right)}=\dfrac{0,0296}{0,04}=0,74\left(M\right)\\C_{M_{MnSO_4}}=C_{M_{H_2SO_4}}=\dfrac{0,0104}{0,04}=0,26\left(M\right)\\C_{M_{K_2SO_4}}=\dfrac{0,0052}{0,04}=0,13\left(M\right)\end{matrix}\right.\)

a, Ta có : \(n_{CO2}=\dfrac{V}{22,4}=0,1\left(mol\right)\)
\(BTNT\left(C\right):n_{MgCO3}=n_{CO2}=0,1\left(mol\right)\)
\(\Rightarrow m_{MgCO3}=n.M=8,4\left(g\right)\)
\(\Rightarrow m_{MgO}=8\left(g\right)\)
b, Thấy sau khi phản ứng xảy ra thu được dung dịch A gồm \(MgSO_4\) và có thể còn \(H_2SO_4\) dư .
\(BTNT\left(Mg\right):n_{MgSO_4}=n_{MgCO3}+n_{MgO}=0,3\left(mol\right)\)
\(PTHH:MgSO_4+Ba\left(OH\right)_2\rightarrow Mg\left(OH\right)_2\downarrow+BaSO_4\downarrow\)
.................0,3............0,3..................0,3..................0,3.............
\(\Rightarrow m_{\downarrow}=m_{Mg\left(OH\right)2}+m_{BaSO4}=87,3\left(g\right)\)
Mà \(\left\{{}\begin{matrix}m\downarrow=110,6\left(g\right)>87,3g\\n_{Ba\left(OH\right)2}=C_M.V=0,45>n_{Ba\left(OH\right)2pu}\left(0,3mol\right)\end{matrix}\right.\)
=> Dung dịch A vẫn còn H2SO4 dư và mol BaSO4 được tạo ra tiếp là :
\(n_{BaSO4}=\dfrac{110,6-87,3}{M}=0,1\left(mol\right)\)
\(PTHH:H_2SO_4+Ba\left(OH\right)_2\rightarrow BaSO_4+2H_2O\)
..................0,1............0,1...............0,1........................
Lại có : \(n_{Ba\left(OH\right)2}=0,45\left(mol\right)\)
=> Trong dung dịch B còn có Ba(OH)2 dư ( dư 0,45 - 0,3 - 0,1 = 0,05mol)
\(\Rightarrow C_{MBa\left(OH\right)2}=\dfrac{n}{V}=\dfrac{0,05}{0,5}=0,1\left(M\right)\)
Vậy ...

\(n_{H_2SO_4}=0,1.2=0,2\left(mol\right)\\ CaO+H_2SO_4\rightarrow CaSO_4+H_2O\\ 0,2.........0,2........0,2\left(mol\right)\\ a.m_{CaSO_4}=136.0,2=27,2\left(g\right)\\ b.m=m_{CaO}=0,2.56=11,2\left(g\right)\\ c.n_{H_2SO_4}=n_{CaO}=0,2\left(mol\right)\\ C\%=C\%_{ddH_2SO_4}=\dfrac{0,2.98}{80}.100=24,5\%\)

PT: \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\) (1)
\(2Fe+6H_2SO_{4\left(đ\right)}\underrightarrow{t^o}Fe_2\left(SO_4\right)_3+3SO_2+6H_2O\) (2)
\(5SO_2+2KMnO_4+2H_2O\rightarrow2MnSO_4+K_2SO_4+2H_2SO_4\) (3)
Ta có: \(n_{H_2}=0,2\left(mol\right)\)
Theo PT (1): \(n_{Fe}=n_{H_2}=0,2\left(mol\right)\)
Theo PT (2): \(n_{SO_2}=\dfrac{3}{2}n_{Fe}=0,3\left(mol\right)\)
\(\Rightarrow V_{SO_2}=0,3.22,4=6,72\left(l\right)\)
Theo PT (3): \(n_{KMnO_4}=\dfrac{2}{5}n_{SO_2}=0,12\left(mol\right)\)
\(\Rightarrow V_{KMnO_4}=\dfrac{0,12}{2}=0,06\left(l\right)\)
Bạn tham khảo nhé!

\(a)CuO+H_2SO_4\rightarrow CuSO_4+H_2O\\ b)n_{CuO}=\dfrac{4}{80}=0,05mol\\ n_{H_2SO_4}=\dfrac{100.20}{100.98}=\dfrac{10}{49}mol\\ \Rightarrow\dfrac{0,05}{1}< \dfrac{10:49}{1}\rightarrow H_2SO_4.dư\\ n_{CuSO_4}=n_{H_2SO_4}=n_{CuO}=0,05mol\\ C_{\%CuSO_4}=\dfrac{0,05.160}{100+4}\cdot100=7,69\%\\ C_{\%H_2SO_4}=\dfrac{\left(10:49-0,05\right)98}{100+4}\cdot100=14,52\%\)

Z n + H 2 S O 4 → Z n S O 4 + H 2
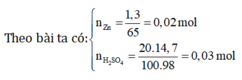 ⇒ Zn phản ứng hết, dd axit còn dư
⇒ Zn phản ứng hết, dd axit còn dư
⇒ n H 2 = n Z n = 0,02 mol
⇒ m H 2 = 2.0,02 = 0,04 g
⇒ Chọn C.
\(SO_3+H_2O\rightarrow H_2SO_4\\ n_{H_2SO_4\left(tổng\right)}=\dfrac{196.10\%}{98}+\dfrac{98a}{80}=0,2+\dfrac{49}{40}a\left(mol\right)\\ m_{ddH_2SO_4\left(tổng\right)}=a+196\left(g\right)\\ Vì:C\%_{ddH_2SO_4\left(cuối\right)}=20\%\\ \Leftrightarrow\dfrac{0,2+\dfrac{49}{40}a}{a+196}.100\%=20\%\\ \Leftrightarrow a\approx38,049\left(g\right)\)