Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Thể tích của dung dịch bari clorua
D = \(\dfrac{m}{V}\Rightarrow V=\dfrac{m}{D}=\dfrac{240}{1,20}=200\left(ml\right)\)
200ml = 0,2l
Số mol của dung dịch bari clorua
CMBaCl2 = \(\dfrac{n}{V}\Rightarrow n=C_M.V=1.0,2=0,2\left(mol\right)\)
Khối lượng của muối natri sunfat
C0/0Na2SO4 = \(\dfrac{m_{ct}.100}{m_{dd}}\Rightarrow m_{ct}=\dfrac{C.m_{dd}}{100}=\dfrac{14,2.400}{100}=56,8\left(g\right)\)
Số mol của muối natri sunfat
nNa2SO4 = \(\dfrac{m_{Na2SO4}}{M_{Na2SO4}}=\dfrac{56,8}{142}=0,4\left(mol\right)\)
Pt : BaCl2 + Na2SO4 → BaSO4 + 2NaCl\(|\)
1 1 1 2
0,2 0,4 0,2
Lập tỉ số so sánh : \(\dfrac{0,2}{1}< \dfrac{0,4}{1}\)
⇒ BaCl2 phản ứng hết , Na2SO4 dư
⇒ Tính toán dựa vào số mol BaCl2
Số mol của dung dịch bari sunfat
nBaSO4 = \(\dfrac{0,2.1}{1}=0,2\left(mol\right)\)
Khối lượng của dung dịch bari sunfat
mBaSO4 = nBaSO4 . MBaSO4
= 0,2 . 233
= 46,6 (g)
Số mol dư của dung dịch natri sunfat
ndư = nban đầu - nmol
= 0,4 - (0,2 . 1)
= 0,2 (mol)
Khối lượng dư của dung dịch natri sunfat
mdư = ndư . MNa2SO4
= 0,2 . 142
= 28,4 (g)
Khối lượng của dung dịch sau phản ứng
mdung dịch sau phản ứng = mBaCl2 + mNa2SO4 - mBaSO4
= 240 + 400 - 46,6
= 593,4 (g)
Nồng độ phần trăm của dung dịch bari sunfat
C0/0BaSO4 = \(\dfrac{m_{ct}.100}{m_{dd}}=\dfrac{46,6.100}{593,4}=7,85\)0/0
Nồng độ phần trăm của dung dịch Natri sunfat
C0/0Na2SO4 = \(\dfrac{m_{ct}.100}{m_{dd}}=\dfrac{28,4.100}{593,4}=4,78\)0/0
Chúc bạn học tốt

600ml = 0,6l
600ml = 0,6l
\(n_{H2SO4}=1.0,6=0,6\left(mol\right)\)
\(n_{BaCl2}=0,5.0,6=0,3\left(mol\right)\)
Pt : \(H_2SO_4+BaCl_2\rightarrow2HCl+BaSO_4|\)
1 1 2 1
0,6 0,3 0,6 0,3
a) Lập tỉ số so sánh : \(\dfrac{0,6}{1}>\dfrac{0,3}{1}\)
⇒ H2SO4 dư , BaCl2 phản ứng hết
⇒ Tính toán dựa vào số mol của BaCl2
\(n_{BaSO4}=\dfrac{0,3.1}{1}=0,3\left(mol\right)\)
⇒ \(m_{BaSO4}=0,3.233=69,9\left(g\right)\)
b) \(n_{HCl}=\dfrac{0,3.2}{1}=0,6\left(mol\right)\)
\(n_{H2SO4\left(dư\right)}=0,6-0,3=0,3\left(mol\right)\)
\(V_{ddspu}=0,6+0,6=1,2\left(l\right)\)
\(C_{M_{HCl}}=\dfrac{0,6}{1,2}=0,5\left(M\right)\)
\(C_{M_{H2SO4\left(dư\right)}}=\dfrac{0,3}{1,2}=0,25\left(M\right)\)
Chúc bạn học tốt

Trong dd ban đầu:
K+_____a mol
Mg2+___b mol
Na+____c mol
Cl-_____a + 2b + c mol
mhhbđ = 74.5a + 95b + 58.5c = 24.625 g______(1)
nAgNO3 = 0.3*1.5 = 0.45 mol
Cho Mg vào A có phản ứng (theo gt) nên Ag(+) còn dư, Cl(-) hết. Rắn C gồm Ag và có thể cả Mg còn dư nữa. Thật vậy, khi cho rắn C vào HCl loãng thì khối lượng rắn bị giảm đi, chính do Mg pư, Ag thì không. Vậy mrắn C giảm = mMg chưa pư với A = 1.92 g.
=> nMg dư = 1.92/24 = 0.08 mol
=> nMg pư với A = 2.4/24 - 0.08 = 0.02 mol________(*)
Khi cho Mg vào A có pư:
Mg + 2Ag(+) ---> 2Ag(r) + Mg(2+)
0.02__0.04
=> nAg(+) pư với dd ban đầu = 0.45 - 0.04 = 0.41 mol
Ag(+) + Cl(-) ---> AgCl(r)
0.41___0.41
Có: nCl(-) = a + 2b + c = 0.41_____________(2)
Trong các cation trên, Mg(2+) và Ag(+) có pư với OH(-), tuy nhiên trong D chỉ có Mg(2+) nên kết tủa là Mg(OH)2:
Mg(2+) + 2OH(-) ---> Mg(OH)2
Khi nung:
Mg(OH)2 ---> MgO + H2O
Ta có: nMg(2+)trongD = nMgO = 4/40 = 0.1 mol
Trong đó 0.02 mol Mg(2+) được thêm vào bằng cách cho kim loại Mg vào (theo (*)), vậy còn lại 0.08 mol Mg(2+) là thêm từ đầu, ta có:
b = 0.08 mol_________________________(3)
(1), (2), (3) => a = 0.15, b = 0.08, c = 0.1
mKCl = 74.5*0.15 = 11.175 g
mMgCl2 = 95*0.08 = 7.6 g
mNaCl = 58.5*0.1 = 5.85 g

\(n_{BaSO_4}=\dfrac{23.3}{233}=0.1\left(mol\right)\)
\(Na_2O+H_2O\rightarrow2NaOH\)
\(BaO+H_2O\rightarrow Ba\left(OH\right)_2\)
\(2NaOH+H_2SO_4\rightarrow Na_2SO_4+H_2O\)
\(Ba\left(OH\right)_2+H_2SO_4\rightarrow BaSO_4+H_2O\)
\(n_{BaO}=n_{Ba\left(OH\right)_2}=n_{BaSO_4}=0.1\left(mol\right)\)
\(m_{BaO}=0.1\cdot153=15.3\left(g\right)\)
\(m_{Na_2O}=24.6-15.3=9.3\left(g\right)\)
\(n_{Na_2O}=\dfrac{9.3}{62}=0.15\left(mol\right)\)
\(\%BaO=62.2\%\)
\(\%Na_2O=37.8\%\)
\(2.\)
\(m_{ddX}=24.6+73.7=98.3\left(g\right)\)
\(n_{H_2SO_4}=\dfrac{0.15}{2}+0.1=0.175\left(mol\right)\)
\(m_{dd_{H_2SO_4}}=\dfrac{0.175\cdot98\cdot100}{19.6}=87.5\left(g\right)\)
\(m_{ddY}=m_{ddX}+m_{ddH_2SO_4}-m_{\downarrow}=98.3+87.5-23.3=162.5\left(g\right)\)
\(C\%_{Na_2SO_4}=\dfrac{0.075\cdot142}{162.5}\cdot100\%=6.55\%\)

a) PTHH: \(MgO+2HCl\rightarrow MgCl_2+H_2O\)
b) Ta có: \(n_{MgO}=\dfrac{8}{40}=0,2\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}n_{MgCl_2}=0,2\left(mol\right)\\n_{HCl}=0,4\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}m_{MgCl_2}=0,2\cdot95=19\left(g\right)\\C\%_{HCl}=\dfrac{0,4\cdot36,5}{200}\cdot100\%=7,3\%\end{matrix}\right.\)
Mặt khác: \(m_{dd\left(sau.p/ứ\right)}=m_{MgO}+m_{ddHCl}=208\left(g\right)\)
\(\Rightarrow C\%_{MgCl_2}=\dfrac{19}{208}\cdot100\%\approx9,13\%\)
c) PTHH: \(MgCl_2+2NaOH\rightarrow2NaCl+Mg\left(OH\right)_2\downarrow\)
Ta có: \(\left\{{}\begin{matrix}n_{MgCl_2}=0,2\left(mol\right)\\n_{NaOH}=\dfrac{200\cdot4\%}{40}=0,2\left(mol\right)\end{matrix}\right.\)
Xét tỉ lệ: \(\dfrac{0,2}{1}>\dfrac{0,2}{2}\) \(\Rightarrow\) NaOH p/ứ hết, MgCl2 còn dư
\(\Rightarrow\left\{{}\begin{matrix}n_{NaCl}=0,2\left(mol\right)\\n_{Mg\left(OH\right)_2}=0,1\left(mol\right)=n_{MgCl_2\left(dư\right)}\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}m_{NaCl}=0,2\cdot58,5=11,7\left(g\right)\\m_{MgCl_2\left(dư\right)}=9,5\left(g\right)\\m_{Mg\left(OH\right)_2}=0,1\cdot58=5,8\left(g\right)\end{matrix}\right.\)
Mặt khác: \(m_{dd\left(sau.p/ứ\right)}=m_{ddA}+m_{ddNaOH}-m_{Mg\left(OH\right)_2}=402,2\left(g\right)\)
\(\Rightarrow\left\{{}\begin{matrix}C\%_{NaCl}=\dfrac{11,7}{402,2}\cdot100\%\approx2,91\%\\C\%_{MgCl_2\left(dư\right)}=\dfrac{9,5}{402,2}\cdot100\%\approx2,36\%\end{matrix}\right.\)
Theo gt ta có: $n_{MgO}=0,2(mol)$
a, $MgO+2HCl\rightarrow MgCl_2+H_2O$
b, Ta có: $n_{HCl}=0,4(mol)\Rightarrow x=7,3$
Bảo toàn khối lượng ta có: $m_{ddA}=208(g)$
$\Rightarrow \%C_{MgCl_2}=9,13\%$
c, Ta có: $n_{NaOH}=0,2(mol)$
$\Rightarrow n_{Mg(OH)_2}=0,1(mol)$
Bảo toàn khối lượng ta có: $m_{ddB}=208+200-0,1.58=402,2(g)$
$\Rightarrow \%C_{MgCl_2}=2,36\%$

nHCl=0,6 mol
FeO+2HCl-->FeCl2+ H2O
x mol x mol
Fe2O3+6HCl-->2FeCl3+3H2O
x mol 2x mol
72x+160x=11,6 =>x=0,05 mol
A/ CFeCl2=0,05/0,3=1/6 M
CFeCl3=0,1/0,3=1/3 M
CHCl du=(0,6-0,4)/0,3=2/3 M
B/
NaOH+ HCl-->NaCl+H2O
0,2 0,2
2NaOH+FeCl2-->2NaCl+Fe(OH)2
0,1 0,05
3NaOH+FeCl3-->3NaCl+Fe(OH)3
0,3 0,1
nNaOH=0,6
CNaOH=0,6/1,5=0,4M
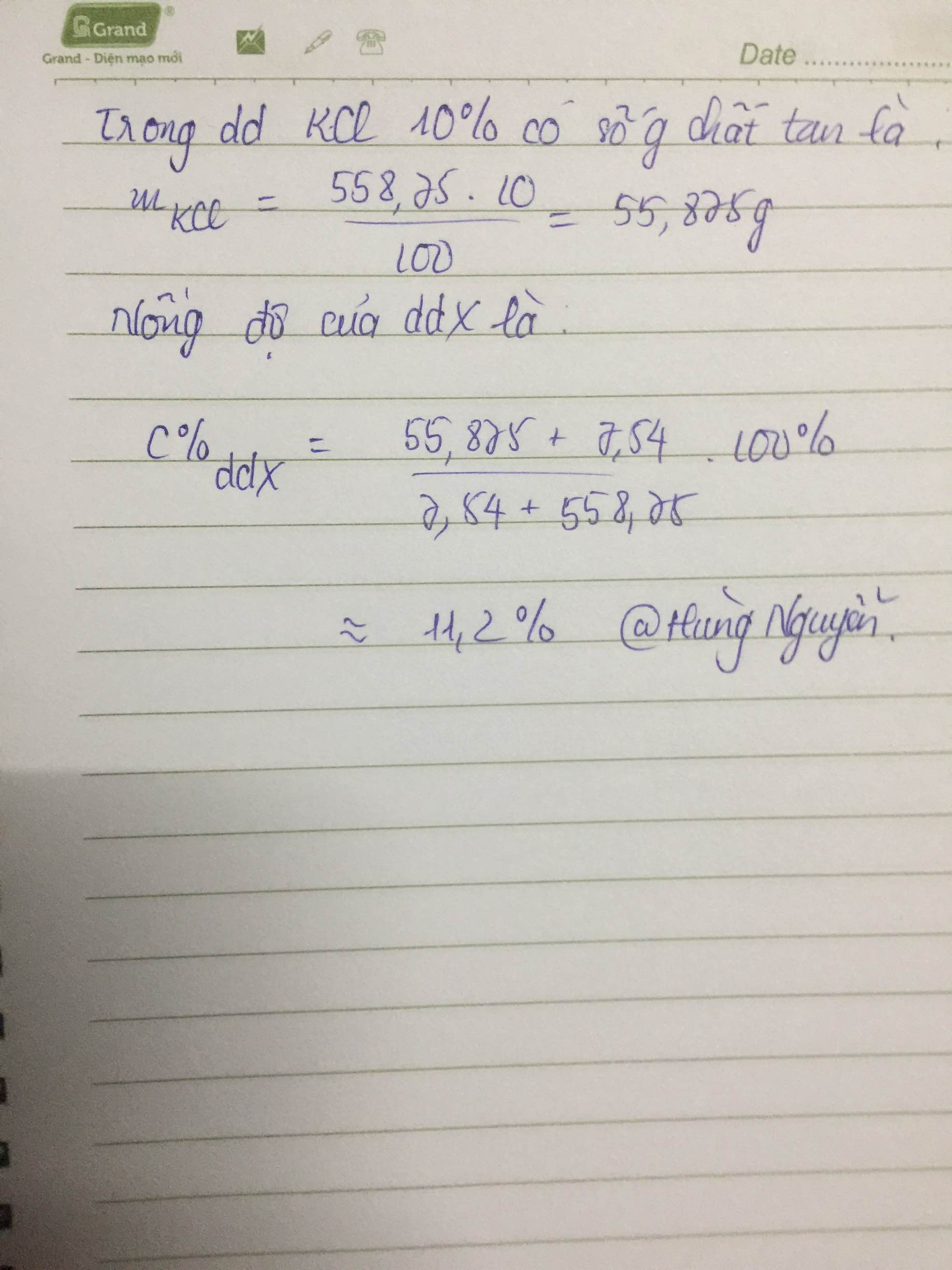
mH2SO4= 147*10%/100%=14.7g
nH2SO4= 1.47/98=0.15 mol
nBaSO4 = 46.6/233=0.2 mol
BaCl2 + H2SO4 --> BaSO4 + 2HCl
_________0.15------>0.15
nBaSO4(còn lại)= 0.2-0.15=0.05 mol
Na2SO4 + BaCl2 --> BaSO4 + 2NaCl
0.05<--------------------0.05
mNa2SO4= 0.05*142=7.1g
mX=mNa2SO4 + mddH2SO4=7,1+147=154,1(g)
=>C%Na2SO4=(7,1*100%)/154,1= 4,61%
Bạn sửa đề hộ mình là 147g dd nhé
mH2SO4= 147*10/100=14.7g
nH2SO4= 1.47/98=0.15 mol
nBaSO4 = 46.6/233=0.2 mol
BaCl2 + H2SO4 --> BaSO4 + 2HCl
_________0.15_____0.15
nBaSO4(cl)= 0.2-0.15=0.05 mol
Na2SO4 + BaCl2 --> BaSO4 + 2NaCl
0.05________________0.05
mNa2SO4= 0.05*142=7.1g
C%Na2SO4 = 7.1/147*100%= 4.83%