Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(a)n_{Mg} = a ; n_{Al} = b \Rightarrow 24a +27b = 5,1(1)\\ Mg + 2HCl \to MgCl_2 + H_2\\ 2Al + 6HCl \to 2AlCl_3 + 3H_2\\ n_{H_2} = a + 1,5b = \dfrac{5,6}{22,4} = 0,25(2)\\ (1)(2) \Rightarrow a = 0,1 ; b = 0,1\\ \%m_{Mg} = \dfrac{0,1.24}{5,1}.100\% = 44,44\%\ ;\ \%m_{Al} = 100\% -44,44\% = 55,56\%\\ b) n_{MgCl_2} = n_{Mg} = 0,1 \Rightarrow m_{MgCl_2} = 0,1.95 = 9,5(gam)\\ n_{AlCl_3} = n_{Al} = 0,1 \Rightarrow m_{AlCl_3} = 0,1.133,5 = 13,35(gam)\\ c)n_{HCl} = 2n_{Mg} + 3n_{Al} = 0,5(mol) \Rightarrow m_{dd\ HCl} = \dfrac{0,5.36,5}{3,65\%} = 500(gam)\)
\(m_{dd\ sau\ pư} = 5,1 + 500 - 0,25.2 = 504,6(gam)\\ C\%_{MgCl_2} = \dfrac{9,5}{504,6}.100\% = 1,89\%\\ C\%_{AlCl_3} = \dfrac{13,35}{504,6}.100\% = 2,65\%\)

a) Gọi số mol Zn, Fe là a, b (mol)
=> 65a + 56b = 8,56 (1)
\(n_{H_2}=\dfrac{3,136}{22,4}=0,14\left(mol\right)\)
PTHH: Zn + 2HCl --> ZnCl2 + H2
a--->2a-------->a----->a
Fe + 2HCl --> FeCl2 + H2
b----->2b------->b------>b
=> a + b = 0,14 (2)
(1)(2) => a = 0,08; b = 0,06
=> \(\left\{{}\begin{matrix}\%m_{Zn}=\dfrac{0,08.65}{8,56}.100\%=60,748\%\\\%m_{Fe}=\dfrac{0,06.56}{8,56}.100\%=39,252\%\end{matrix}\right.\)
b)
nKOH = 0,2.0,1 = 0,02 (mol)
PTHH: KOH + HCl --> KCl + H2O
0,02-->0,02
=> nHCl = 0,02 + 2a + 2b = 0,3 (mol)
=> \(C_{M\left(HCl\right)}=xM=\dfrac{0,3}{0,15}=2M\)
c) m = 0,08.136 + 0,06.127 = 18,5(g)

\(a,n_{H_2}=\dfrac{2,576}{22,4}=0,115\left(mol\right)\\ Đặt:n_{Mg}=a\left(mol\right);n_{Al}=b\left(mol\right)\left(a,b>0\right)\\ Mg+2HCl\rightarrow MgCl_2+H_2\\ 2Al+6HCl\rightarrow2AlCl_3+3H_2\\ \Rightarrow\left\{{}\begin{matrix}95a+133,5b=10,475\\a+1,5b=0,115\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,04\\b=0,05\end{matrix}\right.\\ \%m_{Mg}=\dfrac{0,04.24}{0,04.24+0,05.27}.100\approx41,558\%\Rightarrow\%m_{Al}\approx58,442\%\\ b,n_{HCl}=2.n_{H_2}=2.0,115=0,23\left(mol\right)\\ \Rightarrow x=C\%_{ddHCl}=\dfrac{0,23.36,5}{100}.100=8,395\%\)
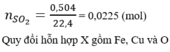
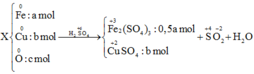
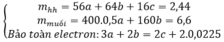
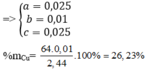









A) Zn + 2HCl ------> ZnCl2 + H2 (1)
Mg + 2HCl ------> MgCl2 + H2 (2)
Gọi x, y lần lượt là số mol của Zn, Mg
Theo đề bài ta có : \(\left\{{}\begin{matrix}65x+24y=11,3\\x+y=\frac{6,72}{22,4}=0,3\end{matrix}\right.\)
\(\Leftrightarrow\left\{{}\begin{matrix}x=0,1\\y=0,2\end{matrix}\right.\)
\(\Rightarrow\%m_{Zn}=\frac{0,1.65}{11,3}.100=57,52\%\)
\(\Rightarrow\%m_{Mg}=100-57,52=42,48\%\)
B) Theo PT (1) : n ZnCl2 = n Zn =0,1 (mol)
\(\Rightarrow m_{ZnCl_2}=0,1.136=13,6\left(g\right)\) Theo PT (2) : n MgCl2 = n Mg =0,2 (mol) \(\Rightarrow m_{MgCl_2}=0,1.95=9,5\left(g\right)\) C)11,3 g hh X gồm 0,1 mol Zn ; 0,2 mol Mg => 5,65g hh X chứa 0,05 mol Zn ; 0,1 mol Mg \(n_T=\frac{3,36}{22,4}=0,15\left(mol\right)\) Quá trình nhường e : Zn-------> Zn 2+ + 2e 0,05........................0,1 Mg-------> Mg 2+ + 2e 0,1............................0,2 Quá trình nhận e : S+6 + ne -------> S+(6-n) ............0,15n..................0,15...... Bảo toàn e : 0,1 + 0,2 = 0,15n => n =2 => Quá trình nhận e : S+6 + 2e -------> S+4 => T là SO2 Khi cho SO2 vào dd NaOH dư => Tạo muối trung hòa SO2 + 2NaOH ------> Na2SO3 + H2O 0,15...............................0,15 => m Na2SO3 = 0,15 . 126 = 18,9 (g)