Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C
Ta có: ![]()
suy ra số mol CO2 trong Z là 0,05 mol tức O bị khử 0,05 mol.
Gọi số mol Fe3O4 và CuO lần lượt là a, b
![]()
Cho Y tác dụng với 1,2 mol HNO3 thu được khí 0,175 mol khí NO2.
Bảo toàn N:
![]()
![]()
Ta có 2 TH xảy ra:
TH1: HNO3 dư.
![]()
![]()
TH2: HNO3 hết.
![]() nghiệm âm loại.
nghiệm âm loại.

Từ khối lượng (m) và số mol (n) của kim loại → M = 
- Từ Mhợp chất → Mkim loại
- Từ công thức Faraday → M =  (n là số electron trao đổi ở mỗi điện cực)
(n là số electron trao đổi ở mỗi điện cực)
- Từ a < m < b và α < n < β →  → tìm M thỏa mãn trong khoảng xác định đó
→ tìm M thỏa mãn trong khoảng xác định đó
- Lập hàm số M = f(n) trong đó n là hóa trị của kim loại M (n = 1, 2, 3), nếu trong bài toán tìm oxit kim loại MxOy thì n =  → kim loại M
→ kim loại M

Đáp án B
Zn có tính khử mạnh hơn Fe, Zn sẽ phản ứng với dung dịch CuSO4 trước.
Theo đề: hỗn hợp rắn Z phản ứng với dung dịch H2SO4 loãng thu được 1 muối duy nhất → trong hỗn hợp rắn Z có Cu và Fe dư. Vậy mFe dư = 0,28 (g) và mCu = 2,84 - 0,28 = 2,56 (g)
Ta có: khối lượng hỗn hợp X phản ứng với Cu2+ = 2,7 - 0,28 = 2,42 (g)
Gọi nZn = x mol; nFe pư = y mol
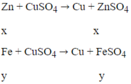
Ta có hệ:
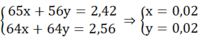
mFe ban đầu = 0,02.56 + 0,28 = 1,4 (g)
![]()

Đáp án C
Pt pư:
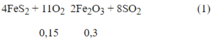
Ta có: nBaC03 = 0,15 mol
nKOH = 0,1 mol ⇒ nBa2+ = 0,15 mol ; nOH- = 0,4 mol
Khi cho SO2 vào dung dịch Y thu được 21,7 (g) BaSO3. Cho Y tác dụng với dung dịch NaOH thấy xuất hiện thêm kết tủa, chứng tỏ trong dung dịch Y có ion HSO3-.
Vì: Ba2+ + HSO3- + OH- " BaSO3 + H2O
Ta có: nBaC03 = 0,1 mol
Ptpứ:
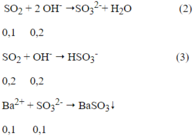
Ta có: nOH- = 0,4 - 0,2 = 0,2 mol
Theo ptpư (2), (3) ta có: n SO2= 0,1 + 0,2 = 0,3 mol
Theo ptpư (1) ta có: n FeS2 = ½ n SO2= 0,15 mol ⇒ m FeS2 = 120.0,15 = 18(g)

Đáp án B
Ta có: n CO2 = 0,1 mol; n BaCO3= 11,82/197 = 0,06 mol; n K2CO3 = 0,02 mol
Khi sục CO2 vào dung dịch hỗn hợp K2CO3 và KOH, giả sử chỉ xảy ra phản ứng:
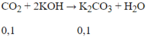
⇒n K2CO3 (trong dd )= 0,1 + 0,02 = 0,12 mol
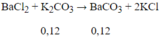
Ta thấy n$ = 0,12 ⇒ n$ đề cho = 0,06 mol
Vậy trong phản ứng CO2 với KOH ngoài muối K2CO3 còn có muối KHCO3
Áp dụng định luật bảo toàn nguyên tố C ta có:
nC(trong CO2) + nC(trong K2CO3) = nC(trong BaCO3) + nC(trong KHCO3)
⇒0,1 + 0,02 = 0,06 + x (x là số mol BaCO3)
⇒x = 0,06

⇒nKOH = 0,14 mol ⇒ [KOH] = 0,14/0,1 = 1,4M

dd Y gồm
x+y mol glu
x mol fruc
0,02 - y mol mantô
với x = 0,006 là số mol sacca pư
y = 0,012 là số mol mantô pư
số mol Ag sinh ra do tráng bạc là 4x+2y+0,04
Kết luận giá trị của m là 9,504

Đáp án C
Phương trình phản ứng:
K2O + H2O → 2KOH
BaO + 2H2O → Ba(OH)2
Al2O3 + OH- → 2AlO2- + H2O
⇒Chất rắn Y: Fe3O4, dung dịch X chứa ion AlO2-
AlO2- + CO2 + H2O → Al(OH)3 + HCO3-

Đáp án D
![]()
Do CuCl2 dư nên kim loại phản ứng hết, X có Cu và HNO3 dư nên Cu cũng phản ứng hết
![]()
⇒ 3.a = 0,15 ⇒ a = 0,05
H2=0.6 => h2so4 dư. => trong Y có 0.2 mol H2SO4.
Gọi nAl=a, nFeSO4=b. Ta có: 3a+2b=1.2 và 27a+56b=22.2
=>a=0.2, b=0.3
Dd y: fe2+: 0.3, al3+: 0.2, so4 2-: 0.8 và h- 0.4
Y td vs ba(oh)2 dư
=> kt thu đc là fe(oh)2: 0.3 mol bà baso4 0.8 mol
*lưu ý al3+ k tạo kt vì oh- dư
=> m kt=213.4g
H2=0.6 => h2so4 dư. => trong Y có 0.2 mol H2SO4.
Gọi nAl=a, nFeSO4=b. Ta có: 3a+2b=1.2 và 27a+56b=22.2
=>a=0.2, b=0.3
Dd y: fe2+: 0.3, al3+: 0.2, so4 2-: 0.8 và h- 0.4
Y td vs ba(oh)2 dư
=> kt thu đc là fe(oh)2: 0.3 mol bà baso4 0.8 mol
*lưu ý al3+ k tạo kt vì oh- dư
=> m kt=213.4g