Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nHNO3 = 1,5. 1,00 = 1,50 (mol)
nNO = 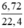 = 0,3(mol)
= 0,3(mol)
PTHH: 3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O (1)
CuO + 2HNO3 → Cu(NO3)2 + H2O (2)
Theo pt(1) nCu = 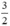 . nNO =
. nNO = 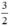 . 0,3 = 0,45 mol
. 0,3 = 0,45 mol
Gọi nCuO = x mol
Ta có: mhỗn hợp = mCu + mCuO = 0,45. 64 + 80x = 30,00
⇒ x = 0,015 ⇒ nCuO = 0,015 mol ⇒ mCuO = 0,015. 80 = 1,2 g
(Hoặc mCuO = 30 - 0,45. 64 = 1,2g)
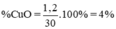
Theo pt(1) nCu(NO3)2 = nCu = 0,45 mol
Theo pt(2) nCu(NO3)2 = nCuO = 0,015 mol
⇒ Tổng nCu(NO3)2 = 0,45 + 0,015 = 0,465(mol)
CMCu(NO3)2 = 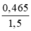 = 0,31(M)
= 0,31(M)
Theo pt (1) nHNO3 = 4. nNO = 4. 0,3 = 1,2 mol
Theo pt (2) nHNO3 = 2. nCuO= 2. 0,015 = 0,03 mol
nHNO3 (dư)= 1,5 - 1,2 – 0,03 = 0,27(mol)
CM HNO3 = 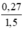 = 0,18(M)
= 0,18(M)

Khi đốt 0,5 mol hỗn hơp M, số mol C O 2 thu đươc là :
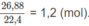
Nếu đốt 1 mol hỗn hợp M, số mol C O 2 thu được sẽ là 2,4 (mol).
Như vậy chất A và chất B có chứa trung bình 2,40 nguyên tử cacbon , chất A lại kém chất B 1 nguyên tử cacbon. Vậy, A có 2 và B có 3 nguyên tử cacbon.
A là ancol no có 2 cacbon: C 2 H 6 - x ( O H ) x hay C 2 H 6 O x
B là axit đơn chức có 3 cacbon: C 3 H y O 2 .
Đặt số mol A là a, số mol B là b :
a + b = 0,5 (1)
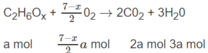
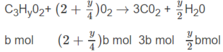
Số mol O 2 là: (3,5 - 0,5x)a + (2 + 0,25y)b = 1,35 (mol) (2)
Số mol C O 2 là: 2a + 3b = 1,2 (mol) (3)
Số mol C O 2 là:
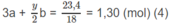
Giải hệ phương trình đại số tìm được: a = 0,3; b = 0,2; x = 2; y = 4.
Chất A:
C
2
H
6
O
2
hay  etanđiol (hay etylenglicol)
etanđiol (hay etylenglicol)
Chiếm  khối lượng M.
khối lượng M.
Chất B: C 3 H 4 O 2 hay C H 2 = C H - C O O H , axit propenoic chiếm 43,64% khối lượng M.

n HNO3 = 1,5 . 1 = 1,5 mol
n NO = 6,72 / 22,4 = 0,3 (mol)
0 +2
Cu -> Cu + 2e
0,45 <--------- 0.9
+5 +2
N + 3e -> NO
0.9 <- 0.3
m Cu = 0.45 . 64 =28.8 (g)
m CuO = 30 - 28,8 = 1,2 (g)
% m CuO = 1,2 / 30 x 100% = 4%
4H(+) + NO3(-) --> NO + 2H2O
1,2 <------ 0,3 <------ 0.3
n CuO = 1,2 / 80 = 0,015 (mol)
2HNO3 + CuO --> Cu(NO3)2 + H2O
0.03 <----- 0,015
=> n HNO3 còn = 1,5 - 1,2 - 0,03 = 0,27 (mol)
CM HNO3 = 0,27 / 1,5 = 1,8 M
CM Cu(NO3)2 = 0,465 / 1,5 = 0,31 M



Có thể xác định được và tiến hành như sau:
Bước 1: Tiến hành thí nghiệm.
Cân hỗn hợp ban đầu, chẳng hạn 10 gam.
Dùng dung dịch HNO3 1M dư phản ứng với hỗn hợp trên: CuO phản ứng với HNO3 tạo thành dung dịch, Fe3O4 phản ứng với HNO3 có khí NO thoát ra sau đó chuyển thành khí NO2 màu nâu đỏ. Đo thể tích khí NO2 tạo thành và quy về điều kiện tiêu chuẩn được V lít.
Bước 2: Tính toán.
Từ kết quả thí nghiệm và phương trình hóa học của Fe3O4 với dung dịch axit nitric, tính được số mol của khí NO. Từ đó tính được phần trăm khối lượng của CuO và Fe3O4 trong hỗn hợp.
PTHH: CuO + 2HNO3 → Cu(NO3)3 + H2O
3Fe3O4 + 28HNO3 → 9Fe(NO3)3 + NO + 14H2O
2NO + O2 ⟶ 2NO2