Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

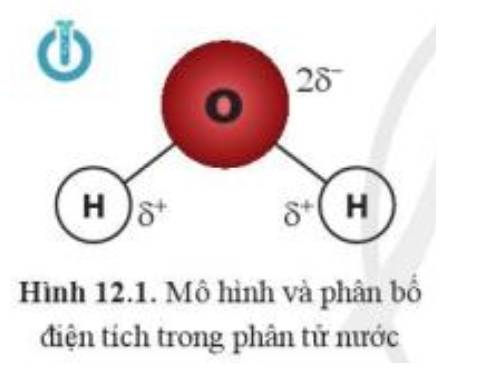
Dựa vào sự phân bố điện tích trong phân tử nước (hình 12.1), liên kết giữa hai phân tử nước được hình thành qua cặp nguyên tử O với H.
Do nguyên tử H mang điện tích dương nên liên kết với nguyên tử mang điện tích âm là O. Ngoài ra O còn 2 cặp electron riêng và độ âm điện lớn hơn H. Vì vậy phân tử H2O được tạo bởi các liên kết hydrogen của cặp nguyên tử O – H, liên kết này có bản chất tĩnh điện, tương tác hút điện giữa và , giúp liên kết hai phân tử H2O với nhau.

Dựa vào hiệu độ âm điện, trong:
* Na2O: liên kết ion.
* MgO: liên kết ion.
* HBr: liên kết công hóa trị phân cực.
* CaBr2: liên kết ion.

Đáp án D
Liên kết ion hình thành giữa kim loại điển hình và phi kim điển hình.

Liên kết ion hình thành giữa kim loại điển hình và phi kim điển hình. Đáp án D

1.Phân tử nào có liên kết cộng hóa trị không cực ?
A. HCl. B. Cl2. (CHỌN B) C. NH3. D. H2O.
2.Liên kết cộng hóa trị có cực tạo thành giữa hai nguyên tử
A. phi kim khác nhau. B. cùng một phi kim điển hình.
C. phi kim mạnh và kim loại mạnh. (Theo anh nhớ là vậy C á) D. kim loại và kim loại.
Nguyên tử H, với cấu hình electron là 1 s 1 có 1 electron hoá trị. Trong phân tử H 2 hai nguyên tử H liên kết với nhau bằng cách mỗi nguyên tử H góp 1 electron tạo thành một cặp electron chung :
Như vậy, trong phân tử H 2 mỗi nguyên tử có 2 electron giống lớp vỏ bền vững của khí hiếm heli (He).
Nguyên tử clo (Cl) có 7 electron hoá trị. Một cách tương tự, trong phân tử Cl 2 mỗi nguyên tử C1 đạt được cấu hình 8 electron ở lớp ngoài cùng giống nguyên tử khí hiếm Ar khi mỗi nguyên tử góp 1 electron tạo thành cặp electron chung :
Liên kết giữa hai nguyên tử H hay giữa hai nguyên tử C1 được gọi là liên kết cộng hoá trị.