Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B.
Nhận định không đúng: 2,4
Số hạt proton có điện tích bằng = +1,602.10-19
Số hạt proton trong X bằng: 27,2.10-19 : 1,602.10-19 = 17.
Cấu hình X là 1s22s22p63s23p5

Ion X- là nguyên tử X đã nhận thêm 1e, số proton và nơtron không thay đổi.Vậy tổng số hạt của nguyên tố X là 115 hạt
Ta có: 2Z+N=115
=> N=115 - 2Z
Ta có : 1≤ \(\dfrac{N}{Z}\) ≤ 1,5
=> 1 ≤ \(\dfrac{115-2Z}{Z}\) ≤1,5
=> 32,86 ≤ Z ≤ 38,33
Mà Z nguyên, vậy Z=33,34,35,36,37,38
Với các giá trị của Z , chọn được nguyên tố cần tìm là Br, thuộc nhóm VIIA

Gọi số e trong mỗi nguyên tử X,Y,Z lần lượt là x,y,z. Theo đề bài ta có hệ phương trình đại số:
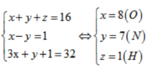

Điện tích của electron : q e = -1,602. 10 - 19 C
Proton mang điện tích dương : q p = -1,602. 10 - 19 C
Hạt nhân cacbon có 6 proton, vây điện tích của hạt nhân nguyên tử cacbon bằng :
q = 1,602. 10 - 19 . 6 = 9,612. 10 - 19 C

Ta có: tổng số hat mang điện là 49 suy ra,ta có công thức
2Z + N = 49 (1)
Mà hạt kmd bằng..hạt mang,nên ta có
N = 53.125×2Z/100 (2)
Từ 1 và 2 ta có hệ pt:
suy ra N = 17
Z = 16
E = 16
từ trên bạn => là đuọc

Ta có: \(\left\{{}\begin{matrix}2Z+N=155\\2Z-N=33\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}Z=47\\N=61\end{matrix}\right.\)
Điện tích hạt nhân: 47+
Nguyên tử khối: 108
Kí hiệu: Ag
\(X(2p, n) \begin{cases} 2p+n=155\\ 2p-n=33 \end{cases}\Leftrightarrow \begin{cases} p=e=47\\ n=61 \end{cases} \to: Ag\)

a)
Cấu hình e: 1s22s22p63s23p64s1
X có 19e => X nằm ở ô thứ 19
X có 1e lớp ngoài cùng => X thuộc nhóm IA
X có 4 lớp e => X ở chu kì 4
b)
K có khuynh hướng nhường 1e để đạt đến cấu hình bền của khí hiếm, tạo thành ion K+
K --> K+ + 1e

1. Ta có tổng số hạt cơ bản của nguyên tố X là 36 , suy ra
p + e + n = 36 => 2p + n = 36
Số hạt mang điện gấp đôi số hạt không mang điện : 2p = 2n => p = n
Vậy : 3p = 36 => p = 12 => số p = số e = số z = 12
Số khối : A = p + n = 12 + 12 = 24
2.
a, Ta có tổng số hạt cơ bản là 54 hạt.
=> p+e+n=54 => 2p+n=54(1)
Vì số hạt mang điện nhiều hơn số hạt không mang điện là 14
=> 2p-n=14(2)
Từ (1) và (2) ta có hệ pt:
2p-n=14
2p+n=54
<=> p=17
n=20
Vậy e=17, p=17, n=20
b, số hiệu nguyên tử Z=17
c, kí hiệu: Cl


Đáp án B.
Theo giả thiết : Hạt nhân của ion X+ có điện tích là 30,4.10-19 C nên nguyên tử X cũng có điện tích hạt nhân là 30,4.10-19 C. Mặt khác mỗi hạt proton có điện tích là 1,6.10-19 C nên suy ra số prton trong hạt nhân của X là:
Số hạt p = 30 , 4 . 10 - 19 1 , 6 . 10 - 19 = 19
Vậy nguyên tử X là Kali (K).