
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



Bảng tính tan cho ta biết, tính tan các chất trong nước: chất nào tan được trong nước, chất nào không tan trong nước, chất nào ít tan trong nước, chất nào dễ phân hủy, bay hơi …Từ đó ta có thể làm các bài nhận biết và các bài toán có kiến thức liên quan
*Tóm lại: Đối với lớp 8 và 9 thì nó dùng để viết phương trình trao đổi

a,0,2 x 56 = 11.2(g)
b,4,5x10^23 x 6 x 10^23 = 0,75 (mol)
0,75 x (24+ 35,5 x 2 ) = 71,25 (g)
c,336 / 22,4 = 15 (mol )
15 x (2 + 16x2 ) = 510 (g)
"gửi bạn nha"

nFe = 0,05 mol
PT : Fe + 2HCl -> FeCl2 + H2
......0,05......0,1...................0,05 ( mol )
V H2 = 0,05 . 22,4 = 1,12 ( l )
mHCl = 0,1 . 36,5 = 3,65 (g)

\(a,PTHH:2Al+6HCl\to 2AlCl_3+3H_2\\ b,n_{Al}=\dfrac{5,4}{27}=0,2(mol)\\ \Rightarrow n_{H_2}=\dfrac{3}{2}n_{Al}=0,3(mol)\\ \Rightarrow V_{H_2}=0,3.22,4=6,72(l)\\ c,n_{AlCl_3}=n_{Al}=0,2(mol)\\ \Rightarrow m_{AlCl_3}=0,2.133,5=26,7(g)\)

\(n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\\ Fe+2HCl\rightarrow FeCl_2+H_2\\ n_{H_2}=n_{Fe}=0,1\left(mol\right);n_{HCl}=0,1.2=0,2\left(mol\right)\\ a,V_{ddHCl}=\dfrac{0,2}{4}=0,05\left(l\right)=50\left(ml\right)\\ b,V_{H_2\left(đktc\right)}=0,1.22,4=2,24\left(l\right)\)

PTHH : 2Al + 6HCl --> 2AlCl3 + 3H2 ↑ (1)
nAlCl3 = \(\dfrac{m}{M}=\dfrac{13,35}{27+35,5.3}=0.1\left(mol\right)\)
Từ (1) => nHCl = 2nH2 = 0.2 (mol)
=> mHCl = n.M = 0.2 x 36.5 = 7.3 (g)
\(PTHH:2Al+6HCl\rightarrow2AlCl_3+3H_2\\ n_{AlCl_3}=\dfrac{m}{M}=\dfrac{13,35}{133,5}=0,1\left(mol\right)\\ Theo.PTHH:n_{HCl}=3.n_{AlCl_3}=3.0,1=0,3\left(mol\right)\\ m_{HCl}=n.M=0,3.36,5=10,95\left(g\right)\)

nCuSO4=0.1(mol)
mH20=160-16=144(g)
>>nH20=144/18=8
trong phân tử H20 có 2 nguyên tử H và 1 nguyên tử O
vậy nó có 3 nguyên tử
trong CuSO4 ta tính là 2 nguyên tử
vậy số gam H20 bay ra giảm đi 1/2
>>mH20 giảm = 73.8 (=4.1 mol nguyên tử )
__mH20 còn lại = 144-73.8=70.2 ( =3.9 mol nguyên tử )
bạn tự trình bày nhé
Công thức đây ; số nguyên tử = số mol X 6.02X10^-23 ( còn gọi là số avogađro) .....

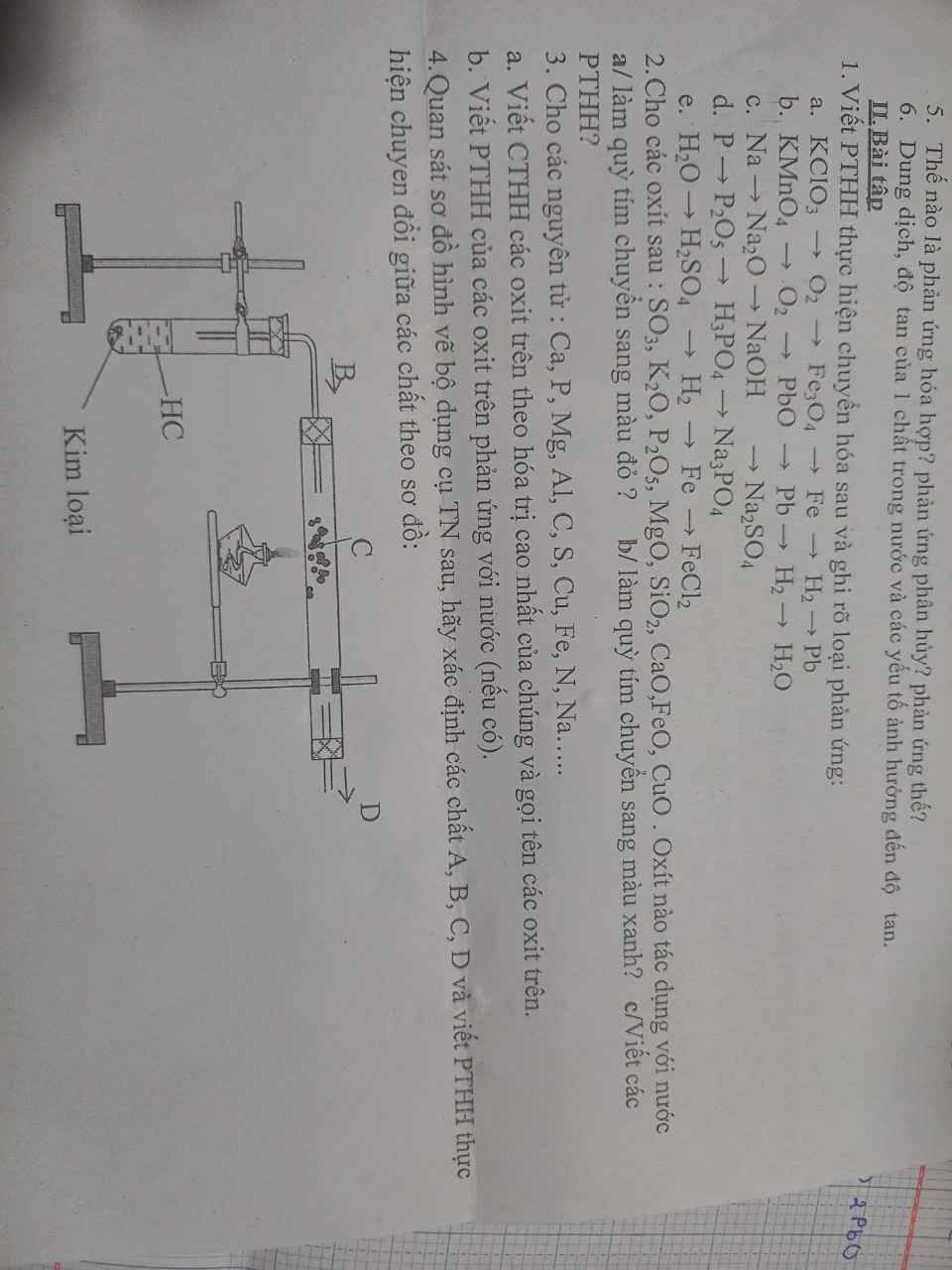 mn giải giúp em với ạ em đag cần gấp , em cảm ơn
mn giải giúp em với ạ em đag cần gấp , em cảm ơn

Bài 1. PTHH: 2Cu + \(O_2\) ---> 2CuO (cân bằng phản ứng)
0,04 mol 0,02 mol 0,04 mol
a) + Số mol của Cu:
\(n_{Cu}\) = \(\dfrac{m}{M}\) = \(\dfrac{2,56}{64}\) = 0,04 (mol)
+ Khối lượng của CuO:
\(m_{Cu}\) = n . M = 0,04 . 80 = 3,2 (g)
b) 2Cu + \(O_2\) ---> 2CuO (viết lại một phương trình mới để kê dữ liệu mol mới)
0,05 mol 0,025 mol 0,05 mol
+ Số mol của CuO:
\(n_{CuO}\) = \(\dfrac{m}{M}\) = \(\dfrac{4}{80}\) = 0,05 (mol)
+ Khối lượng của Cu:
\(m_{Cu}\) = n . M = 0,05 . 64 = 3,2 (g)
c) 2Cu + \(O_2\) ---> 2CuO (viết lại một phương trình mới để kê dữ liệu mol mới)
0,3 mol 0,15 mol 0,3 mol
+ Số mol của CuO:
\(n_{CuO}\) = \(\dfrac{m}{M}\) = \(\dfrac{24}{80}\) = 0,3 (mol)
+ Khối lượng của Cu:
\(m_{Cu}\) = n . M = 0,3 . 64 = 19,2 (g)
+ Thể tích của \(O_2\):
\(V_{O_2}\) = n . 22,4 = 0,15 . 22,4 = 3,36 (l)
________________________________________
Câu 1 trước nha bạn, có gì thì nhắn mình :))
Bài 2. Zn + 2HCl ---> \(ZnCl_2\) + \(H_2\) (Cân bằng phương trình phản ứng)
0,25 mol 0,5 mol 0,25 mol 0,25 mol
*Số mol của Zn:
\(n_{Zn}\) = \(\dfrac{m}{M}\) = \(\dfrac{16,25}{65}\) = 0,25 (mol)
a) \(m_{HCl}\) = n . M = 0,5 . 36,5 = 18,25 (g)
b) \(V_{H_2}\) = n . 22,4 = 0,25 . 22,4 = 5,6 (l)
c) \(m_{ZnCl_2}\) = n . M = 0,25 . 136 = 34 (g)
____________________________________
Đây là Câu 2, nhưng câu c) mình chỉ làm được 1 cách thôi bạn ạ, nếu biết mình sẽ bổ sung thêm :))