Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Câu 1
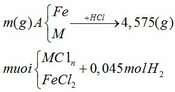
Áp dụng định luật bảo toàn nguyên
tố H ta có:
nHCl = 2nH2 = 2.0,045 = 0,09 mol
Áp dụng định luật bảo toàn khối lượng
ta có: mA + mHCl = m muối + mH2
=> m = m muối + mH2 – mA = 4,575 + 0,045.2 – 0,09.36,5 = 1,38 (gam)
Câu 2
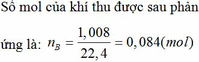
Do cho kim loại phản ứng với H2SO4 đặc và HNO3 đặc nên khí sinh ra là SO2 và NO2.
Áp dụng phương pháp đường chéo ta có:
SO2: 64 4,5
50,5
NO2: 46 13,5
→nSO2=nNO2=4,513,5=13
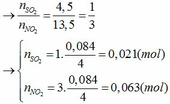
Đặt số mol của Fe và M lần lượt là x và y (mol)
- Khi cho hỗn hợp tác dụng với HCl:
Fe + 2HCl → FeCl2 + H2
x x (mol)
M + nHCl → MCln + 0,5nH2
y 0,5ny (mol)
nH2 = 0,045 => x + 0,5ny = 0,045 (1)
- Khi cho hỗn hợp tác dụng với HNO3 đặc và H2SO4 đặc:
Ta có các bán phản ứng oxi hóa – khử:
Fe → Fe3+ + 3e
x 3x
M → Mn+ + ne
y ny
S+6 + 2e → S+4 (SO2)
0,021 0,042
N+5 + 1e → N+4 (NO2)
0,063 0,063
Áp dụng định luật bảo toàn electron ta có: 3x + ny = 0,042 + 0,063 hay 3x + ny = 0,105 (2)
Từ (1) và (2) ta có hệ phương trình sau:
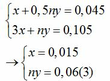
Mặt khác: mA = mFe + mM => 1,38 = 0,015.56 + My => My = 0,54(4)
Từ (3) và (4) suy ra M = 9n
Ta có bảng sau:
| n |
1 |
2 |
3 |
| M |
9 (loại) |
18 (loại) |
27 (nhận) |
Vậy kim loại M là nhôm, kí hiệu là Al.

Goi nFe=x,nR=y.
56x+Ry=11,3.
X+y=0,3.
Tu 2 pt=>R<37,6.(1).
Thi ngiem 2.
=>nH2S04<0,4.
=>12<R.(2).
Tu 1 va 2=>
12<R<37,6.
R htri 2=>R la Mg.

Theo bài ra: nH2 = 1,12/22,4 = 0,05 mol
nHCl < 0,5 x 1 = 0,5 mol
Các phương trình pứ xảy ra:
Fe + 2HCl ===> FeCl2 + H2
N + 2HCl ===> NCl2 + H2 ( đặt công thức chung của hỗn hợp là N)
0,05 0,05 ( giả thiết nhé bạn )
=> MN= 2 / 0,05 = 40 gam
Vì MFe = 56 > 40 => MM < 40 (1)
Mặt khác , ta có: MM > 4,8 / 0,5 = 9,6 (2)
Từ (1), (2), ta có 9,6 < MM < 40 và M hóa trị II
=> M là Magie

Có: nH2SO4 \(=\frac{4,9}{98}=0,05\left(mol\right)\)
Vì: \(x_1+H2S\text{O4}\rightarrow X_2+X_3\) nên X1 có thể là: oxit bazo, oxit lưỡng tính, bazo, hidroxit lưỡng tính, muối. Nhưng vì bài cho X1 có thể là CaO,MgO,NaOH,KOH,Zn và Fe nên loại các trường hợp oxit lưỡng tính, hidroxit lưỡng tính, muối.
TH1: X1 là oxit bazo: CaO,MgO.
Gọi CTPT chung cho X1 là MgO.
PTPU:
MO + H2SO4 → MSO4 + H2O (*) mol
0,05 0,05 0,05
Vậy KL mol của MO là: \(M_{MO}=\frac{2,8}{0,05}=56\left(g\right)\)
Vậy MO là CaO
TH2: Xét X1 là bazo: NaOH, KOH
Gọi CTPT chung cho X1 là MOH.
PTPƯ: 2MOH + H2SO4 → M2SO4 + 2H2SO4 (**)
0,1 0,05 0,05
Vậy KL mol của MOH là: \(M_{MOH}=\frac{2,8}{0,1}=28\left(g\right)\) (không có MOH thỏa mản)
TH3: X1 kim loại Zn và Fe. Gọi CTCP chung cho X1 là M.
PTPU: M + H2SO4 → MSO4 + H2 (***)
0,05 0,05 0,05
Vậy KL mol MO là \(M_M=\frac{2,8}{0,05}=56\left(g\right)\). Vậy M là Fe.
b. X1 là CaO thì X2 là \(m_{CaS\text{O4}}=0,05.136=6,8\left(g\right)\)
(khác bài ra 7,6 g) loại.
X1 là kim loại Fe thì X2 \(m_{FeS\text{O4}}=0,05.152=7,6\left(g\right)\) phù hợp với đề bài như vậy X3 là H2












 =)))
=)))
cảm ơn bạn nhé.