Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Cu Ag Fe Al → O 2 , t 0 Y → HCldu A → NaOH kt → t 0 Z
– Tác dụng với oxi dư
2Cu + O2 →2CuO
4Fe + 3O2→2Fe2O3
4Al + 3O2 →2Al2O3
– Tác dụng với HCl dư
CuO +2HCl → CuCl2 + H2O
Fe2O3 + 6HCl → 2FeCl3 + 3H2O
Al2O3 + 6HCl → 2AlCl3 + 3H2O
– Tác dụng với NaOH dư
NaOH + HCl → NaCl + H2O
CuCl2 + 2NaOH → Cu(OH)2↓ + 2NaCl
FeCl3 + 3NaOH → Fe(OH)3↓ + 3NaCl
AlCl3 + 3NaOH → 2H2O + 3NaCl + NaAlO2
– Nung trong không khí
2Fe(OH)3 →Fe2O3 + 3H2O
Cu(OH)2→CuO + H2O
=> Z gồm CuO và Fe2O3

– Số mol KMnO4 = 0,2 (mol); số mol KOH = 2 (mol)
– Phương trình phản ứng:
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
0,2 0,5
* Ở điều kiện nhiệt độ thường:
Cl2 + 2KOH → KCl + KClO + H2O
0,5 1,0 0,5 0,5
– Dư 1,0 mol KOH
CM (KCl) = CM (KClO) = 0,5 (M); CM (KOH dư) = 1 (M)
* Ở điều kiện đun nóng trên 700C:
3Cl2 + 6KOH → 5KCl + KClO3 + 3H2O
0,5 1,0 5/6 1/6
– Dư 1,0 mol KOH
CM (KCl) = 5/6 (M); CM (KClO3) = 1/6 (M); CM (KOH dư) = 1 (M).

a) \(n_{CuSO_4}=0,02.4=0,08\left(mol\right)\)
PTHH: Fe + CuSO4 --> FeSO4 + Cu
_________0,08------>0,08---->0,08
Chất rắn A gồm Cu và Fe dư
dd B là FeSO4
b)
PTHH: Fe + 2HCl --> FeCl2 + H2
Khối lượng chất rắn còn lại sau phản ứng = mCu = 0,08.64 = 5,12 (g)
c)
PTHH: FeSO4 + 2NaOH --> Fe(OH)2 + Na2SO4
_______0,08--->0,16
=> \(V_{ddNaOH}=\dfrac{0,16}{2}=0,08\left(l\right)\)

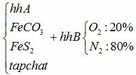
a) Gọi số mol của FeCO3: x (mol) ;
số mol của FeS2: y (mol)
4FeCO3 + O2 → Fe2O3 + 4CO2↑
x → 0,25x → x (mol)
4FeS2 +11O2 → 2Fe2O3 + 8SO2↑
y → 2,75y → 2y (mol)
∑ nO2 = 0,25x + 2,75y (mol)
Cùng điều kiện về nhiệt độ và áp suất nên tỉ lệ về thể tích = tỉ lệ về số mol
=> nN2 = 4nO2 = 4(0,25x + 2,75y)
=> nN2 = x + 11y (mol)
Vậy hỗn hợp Y gồm:
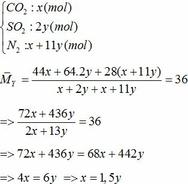
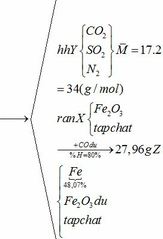
Khối lượng Fe có trong Z là:
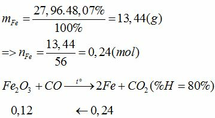
Vì H = 80% => nFe2O3 (trong X) = 0,12. 100% : 80% = 0,15 (mol)
nFe2O3 dư (trong Z) = 0,15 – 0,12 = 0,03 (mol)
Khối lượng tạp chất trong Z = 27,96 – mFe – mFe2O3 dư = 27,96 – 0,24.56 – 0,03.160 = 9,72 (g)
Bảo toàn nguyên tố Fe => nFeCO3 + nFeS2 = 2nFe2O3(trong X)
=> x + y = 0,3 (2)
Từ (1) và (2) => x = 0,18 và y = 0,12 (mol)
Áp dụng công thức PV = nRT ( với n = nCO2 + nSO2 + nN2 = 0,18 + 2. 0,12 + 0,18 +11.0,12 = 1,92)
=> P.10 = 1,92.0,082. (136,5 +273)
=> P = 6,447 ( atm) ≈ 6,5 (atm)
Ta có: mA = mFeCO3 + mFeS2 + mtạp chất = 0,18.116 + 0,12.120 + 9,72 = 45 (g)
![]()
b) hỗn hợp Y gồm:
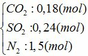
Cho hỗn hợp Y qua O2 ( xúc tác V2O5 ) có phản ứng sau:
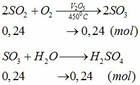
Khối lượng dd sau: mdd sau = mSO3 + mH2O = 0,24. 80 + 592,8 = 612 (g)
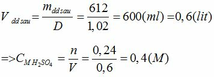

a) Bột Al2O3 tan trong dung dịch HCl
\(Al_2O_3 + 6HCl ⟶ 2AlCl_3 + 3H_2O\)
b) Lá sắt (Fe) tan dần trong dung dịch và sinh ra khí Hidro (H2) làm sủi bọt khí.
\(Fe + H_2SO_4 ⟶ FeSO_4+H_2 \)
c) Chất rắn màu trắng Diphotpho pentaoxit (P2O5) tan dần. Dung dịch axit H3PO4 làm đổi màu giấy quỳ tím thành đỏ.
\(3H_2O + P_2O_5 ⟶ 2H_3PO_4\)
d) Xuất hiện kết tủa trắng Canxi cacbonat (CaCO3) trong dung dịch.
\(Ca(OH)_2 + CO_2 ⟶ CaCO_3 + H_2O\)

Phương trình hóa học:
2CuO + C → 2Cu + CO 2
2PbO + C → 2Pb + CO 2
CO 2 + Ca OH 2 → CaCO 3 + H 2 O
n CaCO 3 = 7,5/100 = 0,075
n C u O = x; n P b O = y


PTHH:
3Fe + 2O2 ==(nhiệt)==> Fe3O4
Fe3O4 + 8HCl ===> FeCl2 + 2FeCl3 + 4H2O
3Fe + 2O2 --to--> Fe3O4
Fe3O4 + 8HCl ---> 2FeCl3 +fecl2 + 4H2O