Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn đáp án B
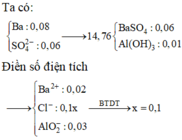
Quan tâm: 1 lít dung dịch X có: ∑nOH = 0,3 mol; nBa2+ = 0,05 mol.
0,1 lít dung dịch Y gồm: 0,08 mol Al+ và (0,12 + 0,1x) mol SO42- và 0,2x mol H+.
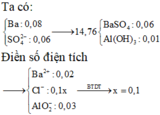
có nSO42- > nBa2+ nên tủa BaSO4 tính theo số mol Ba2+ là 0,05 mol.
⇒ 16,33 gam kết tủa có 0,05 mol BaSO4 ⇒ còn lại là 0,06 mol Al(OH)3↓ có 2TH:
¨ TH1: OH- trung hòa H+, sau đó tạo đúng 0,06 mol Al(OH)3 rồi hết:
H+ + OH- → H2O || 3OH- + Al3+ → Al(OH)3↓.
⇒ ∑nOH- = nH+ + 3nAl3+ ⇒ nH+ = 0,2x = 0,12 mol ⇒ x = 0,6M.
¨ TH2: OH- trung hòa H+, sau đó tạo max kết tủa 0,08 mol rồi tiếp tục hòa tan 0,02 mol:
H+ + OH- → H2O || 3OH- + Al3+ → Al(OH)3↓ || OH- + Al(OH)3 → [Al(OH)4]-
⇒ ∑nOH- = 0,2x + (0,08 × 3 + 0,02) = 0,3 mol ⇒ x = 0,2M.
Vậy có 2 giá trị của x thỏa mãn là 0,2M hoặc 0,6M. Chọn đáp án B
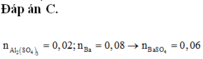
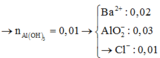
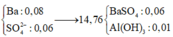


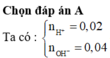
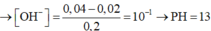

Đáp án B
(*) Phương pháp: Bài toán muối nhôm, kẽm tác dụng với dd kiềm
Trường hợp: cho biết nAl3+ = a và nOH- = b, tính số mol kết tủa:
+ Với muối nhôm. Các phản ứng xảy ra:
A l 3 + + 3 O H - → A l ( O H ) 3 (1)
A l ( O H ) 3 + O H - → [ A l ( O H ) 4 ] - (2)
Phương pháp:
Từ (1) và (2) ta rút ra kết luận:
+Nếu b a ≤ 3 thì kết tủa chưa bị hòa tan và n A l ( O H ) 3 = b 3
+Nếu 3 < b 3 < 4 thì kết tủa bị hòa tan 1 phần
A l 3 + + 3 O H - → A l ( O H ) 3 (1)
Mol a →3a →a
A l ( O H ) 3 + O H - → [ A l ( O H ) 4 ] - ( 2 )
Mol b-3a b-3a
n A l ( O H ) 3 = 4 a - b
Nếu b a ≥ 4 thì kết tủa bị hòa tan hoàn toàn
-Lời giải: nOH = 0,3mol; nBa2+ = 0,05mol
nAl3+ = 0,08mol; nH+ = 0,2x; nSO4 = (0,12 +0,1x)
Vì n S O 4 > n B a 2 + ⇒ n B a S O 4 = n B a 2 + = 0 , 05 m o l
mkết tủa = m B a S O 4 + m A l ( O H ) 3 ⇒ n A l ( O H ) 3 = 0 , 06 m o l < n A l 3 +
nOH-pứ với Al3+ = 0,3 – 0,2x
(*) TH1: A l 3 + dư ⇒ 3 n A l ( O H ) 3 = n A l 3 + ⇒ 0 , 18 = 0 , 3 - 0 , 2 x ⇒ x = 0 , 6 M
(*) TH2: O H - h ò a tan 1 p h ầ n A l ( O H ) 3
⇒ n A l ( O H ) 3 = 4 n A l 3 + - n O H ⇒ 0 , 06 = 4 . 0 , 08 - ( 0 , 3 - 0 , 2 x ) ⇒ x = 0 , 2 M