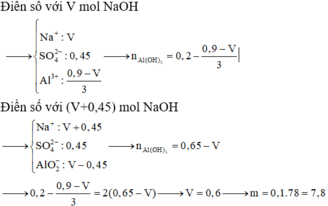Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C
Dung dịch X + AgNO3 dư ⇒ mAgCl = 17,22 gam ⇒ nCl– = 0,12 mol.
+ Bảo toàn điện tích ⇒ nCu2+ = 0,01 mol.
+ Cho dung dịch X + 0,17 mol NaOH.
Tạo 0,04 mol Mg(OH)2 và 0,01 mol Cu(OH)2 tốn 0,1 mol NaOH.
+ Còn 0,07 mol NaOH tác dụng với Al3+.
⇒ nAl(OH)3↓ = 4nAl3+ – OH– = 0,02×4 – 0,07 = 0,01 mol.
⇒ m↓ = 0,04×58 + 0,01×98 + 0,01×78 = 4,08 gam

Đáp án C
nAgCl=0.12 (mol)
BTĐT:

Na+:0.17(mol)
Kết tủa gồm: Al(OH)3:0.01(mol),Cu(OH)2:0.01(mol),
Mg(OH)2:0.04(mol)=> m = 4.08 (g)

Đáp án D
Ta có: x = 0,35 – 0,05.3 = 0,2
Tại điểm kết tủa cực đại là
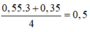
=> z = 0,2.
Khi thêm 0,27 Ba(OH)2 thì thu được kết tủa Z chứa
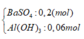
=> m = 51,28 gam

Chọn đáp án C
● Gọi số mol NaOH dùng ở lần 1 là a mol ta có sơ đồ.
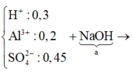
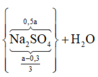
● ⇒ Với nNaOH = (a + 0,45) mol thì nAl(OH)3 = a - 0 , 3 6
+ Ta có sơ đồ:

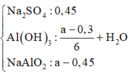
⇒ Ta có nAl(OH)3 = 4nAl(OH)3 – (nNaOH – nH+)
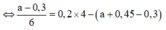
a = 0,6 mol ⇒ VNaOH = 0,6 lít = 600 ml ⇒ Chọn C

Đáp án A
● Bảo toàn nguyên tố Clo: x = nAgCl = 86,1 ÷ 143,5 = 0,6 mol.
Bảo toàn điện tích: y = (0,2 + 0,6 – 0,1 × 3 – 0,2 × 2) ÷ 2 = 0,05 mol.
► NaOH + X → ghép ion. Ghép 0,2 mol NaNO3 và 0,6 mol NaCl
||⇒ dư 0,05 mol Na+ ghép với AlO2– ⇒ còn 0,05 mol Al cho Al(OH)3.
► Kết tủa gồm 0,05 mol Al(OH)3; 0,2 mol Mg(OH)2; 0,05 mol Cu(OH)2.
||⇒ m↓ = 0,05 × 78 + 0,2 × 58 + 0,05 × 98 = 20,4(g)

Đáp án A
● Bảo toàn nguyên tố Clo:
x = nAgCl = 86,1 ÷ 143,5 = 0,6 mol.
Bảo toàn điện tích: y = (0,2 + 0,6 – 0,1 × 3 – 0,2 × 2) ÷ 2 = 0,05 mol.
► NaOH + X → ghép ion.
Ghép 0,2 mol NaNO3 và 0,6 mol NaCl
||⇒ dư 0,05 mol Na+ ghép với AlO2–
⇒ còn 0,05 mol Al cho Al(OH)3.
► Kết tủa gồm 0,05 mol Al(OH)3; 0,2 mol Mg(OH)2; 0,05 mol Cu(OH)2.
||⇒ m↓ = 0,05 × 78 + 0,2 × 58 + 0,05 × 98 = 20,4(g)

Đáp án C
Quy quá trình về: 0,15 mol Glu + 0,35 mol HCl + NaOH dư.
||⇒ nNaOH phản ứng = 2nGlu + nHCl = 0,65 mol