Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nH+ = 0,01.0,2 =0,002 ⇒ nH2SO4 = 0,001
nOH- = 0,1 . 0,1 = 0,01 ⇒ nBa(OH)2 =0,005
⇒ Ba(OH)2 dư
⇒ nBaSO4 = nH2SO4 = 0,001 ⇒ m↓ = 0,233g

$n_{Ba^{2+}} = 0,1.0,5 = 0,05 < n_{SO_4^{2-}} = 0,1$ nên $SO_4^{2-}$ dư
$n_{BaSO_4} = n_{Ba^{2+}} = 0,05(mol)$
$m_{BaSO_4} = 0,05.233 = 11,65(gam)$
$n_{OH^-} = 0,1.0,5.2 + 0,1.0,5 = 0,15(mol)$
$n_{H^+} = 0,1.2 = 0,2(mol)$
$H^+ + OH^- \to H_2O$
$n_{H^+\ dư} = 0,2 - 0,15 = 0,05(mol)$
$V_{dd} = 0,1 + 0,1 + 0,1 = 0,3(lít)$
$[H^+] = \dfrac{0,05}{0,3} = \dfrac{1}{6}M$
$pH = -log( \dfrac{1}{6} ) = 0,778$
\(n_{Ba^{2+}}=0.1\cdot0.5=0.05\left(mol\right)\)
\(n_{OH^-}=0.1\cdot0.5\cdot2+0.1\cdot0.5=0.15\left(mol\right)\)
\(n_{H^+}=2\cdot0.1\cdot1=0.2\left(mol\right)\)
\(n_{SO_4^{2-}}=0.1\left(mol\right)\)
\(Ba^{2+}+SO_4^{2-}\rightarrow BaSO_4\)
\(0.05.........0.05.............0.05\)
\(SO_4^{2-}dư\)
\(m_{\downarrow}=0.05\cdot233=11.65\left(g\right)\)
\(H^++OH^-\rightarrow H_2O\)
\(0.15.......0.15\)
\(n_{H^+\left(dư\right)}=0.2-0.15=0.05\left(mol\right)\)
\(\left[H^+\right]=\dfrac{0.05}{0.1+0.1+0.1}=\dfrac{1}{6}\)
\(pH=-log\left(\dfrac{1}{6}\right)=0.77\)

Chọn B
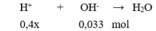
Dung dịch sau phản ứng có pH = 2 < 7 nên dung dịch sau phản ứng có H + dư
→ 0,4x – 0,033 = 10 - 2 .0,3 → x = 0,09

a, \(\left[H^+\right]=10^{-5}\Rightarrow n_{H^+}=0,22.10^{-5}\left(mol\right)\)
\(\left[OH^-\right]=10^{-5}\Rightarrow n_{OH^-}=0,18.10^{-5}\left(mol\right)\)
\(\Rightarrow n_{H^+dư}=0,04.10^{-5}=4.10^{-7}\left(mol\right)\)
\(\Rightarrow\left[H^+\right]=\dfrac{4.10^{-7}}{0,22+0,18}=10^{-8}\)
\(\Rightarrow pH=8\)

Đáp án D
2H+ +CO32- →CO2+ H2O
0,1← 0,1
Ba2++ CO32- →BaCO3
0,1→ 0,1
Ba2++ SO42- →BaSO4
0,1 ← (43-0,1.197)/233
NH4++ OH- →NH3+ H2O
0,2← 0,2
Áp dụng ĐLTBT ĐT có: 1.nNa++ 0,2.1=0,1.2+0,1.2 suy ra nNa+= 0,2 mol
tổng khối lượng muối có trong 500ml dung dịch X là: (0,2.23+0,1.60+0,1.96+0,2.18).5= 119 gam

Đáp án B
Gọi số mol các ion K+, HCO3-, Cl- và Ba2+ có trong 100 ml dung dịch lần lượt là x, y, z, t mol
-Phần 1: HCO3-+ OH-→ CO32-+ H2O
y y y
Ba2++ CO32-→ BaCO3
t y t mol = 0,1 mol
-Phần 2:
HCO3-+ OH-→ CO32-+ H2O
y y y
Ba2++ CO32-→ BaCO3
y y = 0,15
-Phần 3:
Ag++ Cl-→ AgCl
2z 2z = 0,2 mol suy ra z = 0,1 mol
Theo ĐLBT ĐT thì: x+2t=y+z suy ra x=0,05 mol
đun sôi đến cạn 50 ml dung dịch X thì khối lượng chất rắn khan thu được là
(39x+ 61y + 35,5.z+ 137t)/2= 14,175 gam

Đáp án C
Gọi số mol mỗi ion NH4+, K+, CO32-, SO42- trong mỗi phần lần lượt là x, y, z , t mol
Phần 1: Ba2++ CO32-→ BaCO3
z z
Ba2++ SO42- → BaSO4
t t
NH4++ OH-→ NH3+ H2O
x x = 0,3 mol
mkết tủa= mBaCO3+ mBaSO4= 197z+233t= 43 suy ra t= 0,1 mol
Phần 2: 2H++ CO32- → CO2+ H2O
z mol z mol= 0,1
Định luật bảo toàn điện tích: x+y=2z+ 2t suy ra y= 0,1 mol
mmuối= (18x+ 39y+60z+96t).2= 49,8 gam

Đáp án B
Ta có: nHCl = 0,036 mol, nHNO3 = 0,036 mol, nH2SO4 = 0,024 mol
⇒ ∑nH+ = 0,12 mol || ∑nOH– = 0,08×2×V + 0,23×V = 0,39V.
+ Vì pH = 2 ⇒ Sau pứ trung hòa nH+ dư = 102×(0,36+V) = 0,01V + 0,0036
+ Ta có: ∑nH+ = ∑nOH– + nH+ dư ⇔ 0,12 = 0,39V + 0,01V + 0,0036.
Û V = 0,291 lít ⇒ nBa(OH)2 = 0,02328 mol.
+ Vì nBa2+ < nSO42– ⇒ m↓ = mBaSO4 = 0,02328×233 ≈ 5,42 gam
Đáp án A
nH+ = 0,01.0,2 =0,002 ⇒ nH2SO4 = 0,001
nOH- = 0,1 . 0,1 = 0,01 ⇒ nBa(OH)2 =0,005
⇒ Ba(OH)2 dư
⇒ nBaSO4 = n H2SO4 = 0,001 ⇒ m↓ = 0,233g
Đáp án A.