Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

n g l u c o z o = 1 2 . n A g = 1 2 . 32 , 4 108 = 0 , 15 m o l ⇒ m g l u c o z o = 0 , 15 . 180 = 27 g
⇒ Chọn C.

n A g = 16,2/108 = 0,15 mol
Vì H = 75% nên ta có:
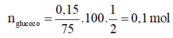
⇒ m g l u c o z o = 0,1.180 = 18g
⇒ Chọn B.

Chọn D
3 cacbohidrat tráng gương được là: glucozo, fructozo, mantozo và tỉ lệ tạo Ag đều là 1 : 2.
nglucozo = (36 . 10%) : 180 = 0,02
=> mAg = 0,02 . 2 . 60% . 108 = 2,592g

2. Hỗn hợp X gồm etilen và axetilen, tỉ khối hơi của X so với hiddro bằng 13.25 m gam hỗn hợp X làm mất màu tối đa 16.8 gam brom. Tìm m (gam)?
________________________________
Gọi số mol C2H4 và C2H2 là a và b
Khối lượng mol hỗn hợp khí=13,25.2=26,5
\(\frac{28a+26b}{a+b}=26,5\)
Ta có C2H4+Br2\(\rightarrow\)C2H4Br2
_______a___ a
C2H2+2Br2->C2H2Br4
b______2b
Ta có a+2b=nBr2=\(\frac{16,8}{160}\)=0,105
\(\rightarrow\)a=0,015; b=0,045
\(\rightarrow\)m=mC2H4+mC2H2=0,015.28+0,045.26=1,59g
1.
Tinh bột \(\rightarrow\) Glucozo
Phần 1 cho tác dụng với AgNO3/NH3 thu được 24,03 gam Ag.
\(\rightarrow\) nAg=\(\frac{24,03}{108}\)=0,2225 mol
\(\rightarrow\)nGlucozo=1/2nAg=0,11125 mol
Phần 2 lên men rượu chứng cất thu được 278,5 ml dung dịch ancol etylic 75%
Glucozo \(\rightarrow\)2 C2H5OH + 2CO2
\(\rightarrow\)V etylic=278,5.75%=208,875 ml
\(\rightarrow\) m etylic=208,875.0,8=167,1 gam
\(\rightarrow\) n etylic=\(\frac{167,1}{46}\)=3,633 mol
\(\rightarrow\) Theo lý thuyết n glucozo trong phần 2 =1/2 n etylic=1,18165 mol
Nhưng hiệu suất =80%\(\rightarrow\) nGlucozo trong phần 2=1,477 mol
\(\rightarrow\) nGlucozo trong dung dịch ban đầu=0,11125+1,477=1,58825 mol
\(\rightarrow\) nC6H10O5=nglucozo /72%=2,2 mol \(\rightarrow\)m=2,2.162=356,4 gam

a, \(n_{CaCO_3}=\dfrac{20}{100}=0,2\left(mol\right)\)
PTHH: Ca(OH)2 + CO2 ---> CaCO3 + H2O
0,2<--------0,2
C6H12O6 --men rượu--> 2CO2 + 2C2H5OH
0,1<------------------------0,2------>0,2
\(\Rightarrow m_{C_6H_{12}O_6}=\dfrac{0,1.180}{80\%}=22,5\left(g\right)\)
b, Các chất hc thu được: C6H12O6 chưa phản ứng hiết và C2H5OH
\(\Rightarrow\left\{{}\begin{matrix}m_{C_6H_{12}O_6\left(chưa.pư\right)}=22,5-0,1.180=4,5\left(g\right)\\m_{C_2H_5OH}=0,2.46=9,2\left(g\right)\end{matrix}\right.\)
\(n_{CaCO_3}=\dfrac{20}{100}=0,2mol\)
\(Ca\left(OH\right)_2+CO_2\rightarrow CaCO_3+H_2O\)
0,2 0,2 ( mol )
\(C_6H_{12}O_6\rightarrow\left(t^o,men.rượu\right)2C_2H_5OH+2CO_2\)
0,1 0,2 0,2 ( mol )
\(m_{C_6H_{12}O_6}=0,1.180.80\%=14,4g\)
\(m_{C_2H_5OH}=0,2.46=9,2g\)

Đáp án: D
T a c ó : m d u n g d ị c h g i ả m = m C a C O 3 - m C O 2 = > m C O 2 = m C a C O 3 – m d u n g d ị c h g i ả m = 10 – 3 , 4 = 6 , 6 g a m n C O 2 = 6 , 6 44 = 0 , 15 m o l C 6 H 12 O 6 → m e n r ư ợ u 2 C 2 H 5 O H + 2 C O 2
T h e o P T H H ( 1 ) t a c ó : n g l u c o z ơ ( L T ) = 1 2 n C O 2 = 1 2 0 , 15 = 0 , 075 m o l = > m g l u c o z ơ ( L T ) = 0 , 075 . 180 = 13 , 5 g a m V ì h i ệ u s u ấ t p h ả n ứ n g H = 90 % - > m g l u c o z ơ ( T T ) = 13 , 5 90 . 100 = 15 g a m

Bài tập 7: Hòa tan hoàn toàn 20,4 gam oxit kim loại R hóa trị (III) trong 300 ml dung dịch H2SO4, sau khi phản ứng hoàn toàn thu được 68,4 gam muối khan.
a/ Xác định công thức hóa học của oxit kim loại R.
b/ Tính nồng độ mol của dung dịch H2SO4 đã dùng.
-------
a) - Gọi oxit của kim loại R(III) cần tìm là R2O3 .
PTHH: R2O3 + 3 H2SO4 -> R2(SO4)3 + 3 H2O
Theo PTHH: 2MR + 48 (g) ______2MR + 288(g)
Theo đề: 20,4(g)______________68,4(g)
Theo PTHH và đề bài ta có:
\(68,4.\left(2M_R+48\right)=20,4.\left(2M_R+288\right)\)
<=> 136,8MR +3283,2 = 40,8 MR + 5875,2
<=> 136,8 MR - 40,8 MR = 5875,2 - 3283,2
<=>96MR = 2592
=> MR = 2592/96 = 27(g/mol)
=> Kim loại R(III) là nhôm (Al=27)
=> Oxit cần tìm là nhôm oxit (Al2O3)
b) nAl2O3= 20,4/102= 0,2(mol)
=> nH2SO4 = 3.0,2= 0,6(mol)
VddH2SO4= 300(ml)= 0,3(l)
=> \(C_{MddH2SO4}=\dfrac{0,6}{0,3}=2\left(M\right)\)
Bài tập 14: Người ta khử 29 gam sắt từ oxit bằng khí cacbon oxit ở nhiệt độ cao. Tính khối lượng sắt thu được sau phản ứng, biết hiệu suất của phản ứng là 80%.
-------
Giaỉ:
PTHH: Fe3O4 +4 CO -to-> 3 Fe + 4 CO2
nFe2O3= 29/232= 0,125(mol)
=> nFe(lí thuyết)= 3. 0,125 = 0,375(mol)
Vì: H= 80%. Nên:
nFe(thực tế)= 0,375. 80%= 0,3(mol)
=>mFe(thực tế)= 0,3.56= 16,8(g)
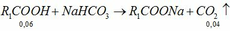
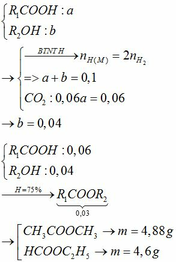
Vì H = 75% nên:
n A g = 2 . n g l u c o z o 100 . 75 = 2 . 54 180 100 . 75 = 0 , 45 m o l
⇒ m A g = 0,45.108 = 48,6g
⇒ Chọn B.