Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

PT: CuO + H2 ---> Cu + H2O
a. Ta có: \(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
Theo PT: nCu = \(n_{H_2}=0,3\left(mol\right)\)
=> mCu = 0,3 . 64 = 19,2(g)
Theo PT: \(n_{H_2O}=n_{Cu}=0,3\left(mol\right)\)
=> \(m_{H_2O}=0,3.18=5,4\left(g\right)\)
b. Theo PT: nCuO = nCu = 0,3(mol)
=> mCuO = 0,3 . 80 = 24(g)

a) \(n_{CuO}=\dfrac{16}{80}=0,2\left(mol\right)\)
PTHH: \(CuO+H_2\xrightarrow[]{t^o}Cu+H_2O\)
0,2--->0,2---->0,2
\(\Rightarrow m_{Cu}=0,2.64=12,8\left(g\right)\)
b) \(V_{H_2}=0,2.22,4=4,48\left(l\right)\)
c) \(2H_2+O_2\xrightarrow[]{t^o}2H_2O\)
0,2--->0,1
\(\Rightarrow V_{O_2}=0,1.22,4=2,24\left(l\right)\)
a: CuO+H2->Cu+H2O
0,2 0,2 0,2 0,2
mCu=0,2*64=12,8(g)
b: V=0,2*22,4=4,48(lít)

a) PTHH : \(2Al+6HCl-->2AlCl_3+3H_2\) (1)
\(Fe+2HCl-->FeCl_2+H_2\) (2)
\(H_2+CuO-t^o->Cu+H_2O\) (3)
b) Ta có : \(m_{CR\left(giảm\right)}=m_{O\left(lay.di\right)}\)
=> \(m_{O\left(lay.di\right)}=32-26,88=5,12\left(g\right)\)
=> \(n_{O\left(lay.di\right)}=\frac{5,12}{16}=0,32\left(mol\right)\)
Theo pthh (3) : \(n_{H_2\left(pứ\right)}=n_{O\left(lay.di\right)}=0,32\left(mol\right)\)
=> \(tổng.n_{H_2}=\frac{0,32}{80}\cdot100=0,4\left(mol\right)\)
Đặt \(\hept{\begin{cases}n_{Al}=a\left(mol\right)\\n_{Fe}=b\left(mol\right)\end{cases}}\) => \(27a+56b=11\left(I\right)\)
Theo pthh (1) và (2) : \(n_{H_2\left(1\right)}=\frac{3}{2}n_{Al}=\frac{3}{2}a\left(mol\right)\)
\(n_{H_2\left(2\right)}=n_{Fe}=b\left(mol\right)\)
=> \(\frac{3}{2}a+b=0,4\left(II\right)\)
Từ (I) và (II) => \(\hept{\begin{cases}a=0,2\\b=0,1\end{cases}}\)
=> \(\hept{\begin{cases}m_{Al}=27\cdot0,2=5,4\left(g\right)\\m_{Fe}=56\cdot0,1=5,6\left(g\right)\end{cases}}\)

a)\(n_{Fe}=\dfrac{16,8}{56}=0,3mol\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
0,3 0,3 0,3
\(V_{H_2}=0,3\cdot22,4=6,67l\)
\(m_{FeCl_3}=0,3\cdot127=38,1g\)
b)\(n_{Fe_2O_3}=\dfrac{18}{160}=0,1125mol\)
\(Fe_2O_3+3H_2\rightarrow2Fe+3H_2O\)
0,1125 0,3 0 0
0,1 0,3 0,2 0,3
0,0125 0 0,2 0,3
\(m_{Fe}=0,2\cdot56=11,2g\)

Theo gt ta có: $n_{CuO}=0,1(mol)$
$CuO+H_2\rightarrow Cu+H_2O$
a, CuO từ màu đen bị khử dần thành màu đỏ đặc trưng của Cu
c, Ta có: $n_{Cu}=n_{CuO}=0,1(mol)\Rightarrow m_{Cu}=6,4(g)$
a) Sau phản ứng thì chất rắn màu đen chuyển thành chất rắn màu đỏ, có hơi nước tạo thành
b) \(CuO+H_2\rightarrow Cu+H_2O\)
c) \(n_{CuO}=\dfrac{8}{80}=0,1\left(mol\right)\)
Theo pt \(n_{Cu}=n_{CuO}=0,1\left(mol\right)\)
\(m_{Cu}=0,1.64=6,4\left(g\right)\)

\(n_{Ba}=\dfrac{24,66}{137}=0,18\left(mol\right)\\
pthh:Ba+2H_2O\rightarrow Ba\left(OH\right)_2+H_2\)
0,18 0,18
\(\Rightarrow V_{H_2}=0,18.22,4=4,032\left(L\right)\\
n_{CuO}=\dfrac{15,2}{80}=0,19\left(mol\right)\\
pthh:H_2+CuO\underrightarrow{t^o}Cu+H_2O\)
\(LTL:0,18< 0,19\)
=> CuO dư
theo pthh : \(n_{CuO\left(p\text{ư}\right)}=n_{Cu}=n_{H_2}=0,18\left(mol\right)\)
=> \(m_{Kl}=\left(64.0,18\right)+\left(80.0,1\right)=19,52\left(g\right)\)

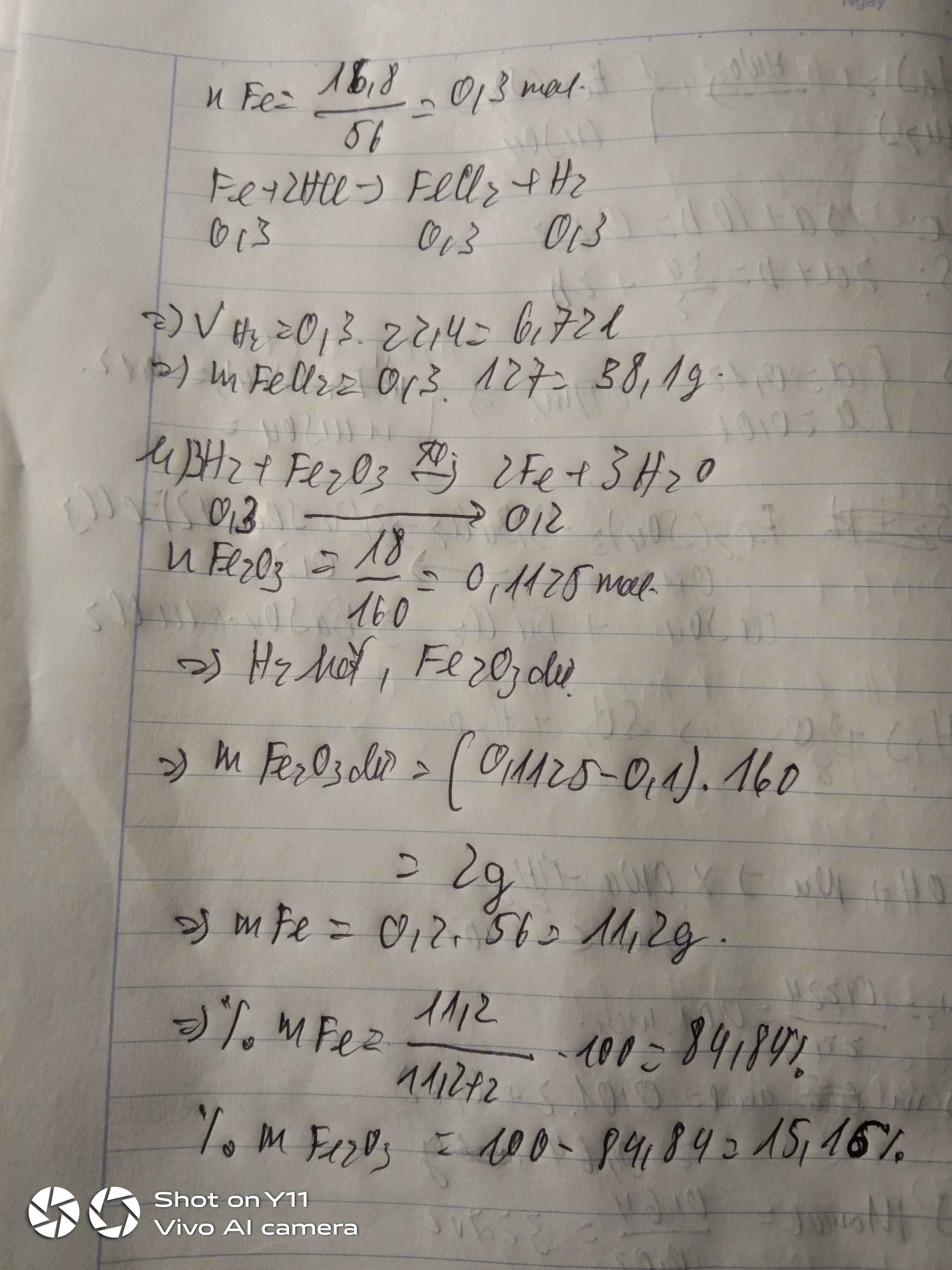
\(n_{H_2\left(bđ\right)}=\dfrac{1.344}{22.4}=0.06\left(mol\right)\)
\(n_{H_2\left(dư\right)}=\dfrac{0.448}{22.4}=0.02\left(mol\right)\)
\(\Rightarrow n_{H_2\left(pư\right)}=0.06-0.02=0.04\left(mol\right)\)
\(CuO+H_2\underrightarrow{^{^{t^0}}}Cu+H_2O\)
\(.......0.04..0.04\)
\(m_{Cu}=0.04\cdot64=2.56\left(g\right)\)
\(2NaCl+2H_2O\underrightarrow{^{^{dpcmn}}}2NaOH+2H_2+Cl_2\)
\(0.04...........................................0.04\)
\(m_{NaCl}=0.04\cdot58.5=2.34\left(g\right)\)