Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Giải thích: Đáp án C
Khi điện phân AgNO3 :
Catot : Ag+ + 1e -> Ag
Anot : 2H2O -> 4H+ + 4e + O2
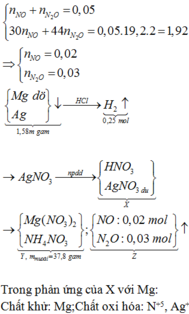
- Mg + X thu được hỗn hợp kim loại => Ag+ dư
- Hỗn hợp kim loại + HCl => nMg = nH2 = 0,005 mol => nAg = 0,002 mol
Hỗn hợp khí là sản phẩm khử của Mg với H+ và NO3- (Mg dư)
nNO + nN2O = 0,005 mol
mNO + mN2O = 2.19,2.0,005 = 0,192g
=> nNO = 0,002 ; nN2O = 0,003 mol
Gọi nNH4NO3 = x mol
Bảo toàn e : nMg(NO3)2 = nMg + HNO3 + nMg + Ag+ = ½ (3nNO + 8nN2O + 8nNH4NO3) + ½ nAg
= ½ (3.0,002 + 8.0,003 + 8x) + ½ .0,002 = 0,016 + 4x
=> mmuối = mMg(NO3)2 + mNH4NO3 = 148(0,016 + 4x) + 80x = 3,04g
=> x = 0,001 mol
=> nH+(X) = 4nNO + 10nN2O + 10nNH4NO3 = 0,048 mol = ne
Định luật Faraday : ne.F = It => t = 2316 (s)

Chọn A.
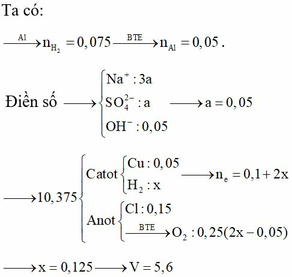
Tại thời điểm t (s) tại anot thu được khí Cl2 (0,05 mol) Þ ne (1) = 0,1 mol
Tại thời điểm 3,5t (s) tại anot có:
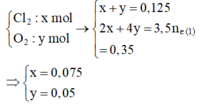
![]() và dung dịch Y chứa Cu2+ dư (a mol), H+ (0,2 mol), NO3-, K+
và dung dịch Y chứa Cu2+ dư (a mol), H+ (0,2 mol), NO3-, K+
Khi cho Y tác dụng với Fe thì: nFe pư =
= 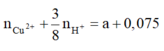
Chất rắn thu được gồm Fe dư và Cu Þ 20 – 56.(a + 0,075) + 64a = 16,4 Þ a = 0,075
Vậy dung dịch X gồm Cu(NO3)2 (0,25 mol) và KCl (0,15 mol) Þ m = 58,175 (g).












Đáp án A