Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
Dun dịch X gồm AgNO3 dư (x mol) và HNO3 (x mol)
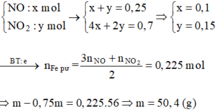
Dung dịch Y chứa Fen+ (0,05 mol) và NO3- (0,14 mol) => m = 11,48 (g).

Đáp án A
Xét phản ứng điện phân: 4AgNO3 + 2H2O → 4Ag↓ + O2↑ + 4HNO3.
Đặt nO2 = x ⇒ nAg = 4x ⇒ mdung dịch giảm = 108 × 4x + 32x = 9,28(g)
⇒ x = 0,02 mol ⇒ Dung dịch X chứa AgNO3 và HNO3 đều 0,08 mol.
Xét phản ứng Fe + dung dịch X: nFe = 0,05 mol.
Ta có: 4H+ + NO3– + 3e → NO + 2H2O
Ag+ + e → Ag↓ ⇒ ne = 0,14 mol.
Do ne : nFe = 2,8 ⇒ Fe tan hết. Lại có: nNO3– = ne = 0,14 mol.
⇒ mmuối = mFe + mNO3 = 2,8 + 0,14 × 62 = 11,48(g)

Chọn A
Điện phân dung dịch AgNO3 sau một thời gian được dung dịch X chứa 2 chất tan cùng nồng độ vậy 2 chất đó là AgNO3 và HNO3.
Dung dịch bị giảm đi là do Ag và O2 thoát ra.
Gọi số mol Ag bị điện phân là x, suy ra O2 là 0,25x.
108x+32.0,25x = 9,28
x=0,08 mol
Do vậy dung dịch X chứa 0,08 mol AgNO3 dư và 0,08 mol HNO3.
Thêm tiếp 0,05 mol Fe vào X các quá trình nhận e:
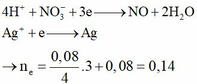
Do vậy Y chứa muối là Fe(NO3)2 0,01 mol và Fe(NO3)3 0,04 mol.
Tổng khối lượng muối là 11,48 gam.

Giải thích: Đáp án A
PTHH: 4AgNO3 + 2H2O → 4Ag ↓ + O2 ↑ + 4HNO3
x → x → 0,25x → x
Gọi nAgNO3 bị điện phân là x (mol)
Ta có: mdd giảm = mAg + mO2
=> 108x + 0,25x. 32 = 9,28
=> x = 0,08 (mol)
Theo đề bài dd X là AgNO3 và HNO3 có nồng độ mol/l bằng nhau => nAgNO3 dư = nHNO3 = 0,08 (mol)
Fe + 4H+ + NO3- → Fe3+ + NO + 2H2O (1)
PƯ 0,02 ←0,08→0,02→ 0,02
Dư 0,03 0,14
Fe + 2Ag+ → Fe2+ + 2Ag↓ (2)
Pư 0,03 → 0,06 → 0,03
Dư 0,02
Ag+ + Fe2+ → Fe3+ + Ag↓ (3)
Pư 0,02 → 0,02→ 0,02
Sau phản ứng (1), (2) (3) => nFe2+ = nFe2+ (2) – nFe2+ (3) = 0,03- 0,02 = 0,01 (mol)
nFe3+ = nFe3+ (1) + nFe3+ (3) = 0,02 + 0,02 = 0,04 (mol)
Vậy dd Y gồm : Fe(NO3)2: 0,01 mol; Fe(NO3)3: 0,04 (mol)
=> m= 0,01. 180 + 0,04. 242 = 11,48 (g)

Đáp án D
Phương trình điện phân:
![]()
X chứa 2 chất tan cùng nồng độ mol => n HNO 3 = n AgNO 3 ( X )
=> Chứng tó AgNO3 bị điện phân hết một nửa
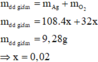
0,05 mol Fe + X
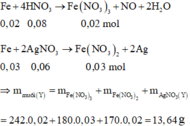

Đáp án A
Hai chất tan trong X là AgNO3 dư và HNO3 mới được tạo sau điện phân.
Theo đó, dung dịch ra Ag2O ứng với giảm 9,28 gam → số mol là 0,04 mol.
Từ lượng ra → đọc ngược lại có 0,08 mol HNO3 (tương quan 2H với 1O).
« Nhận xét:
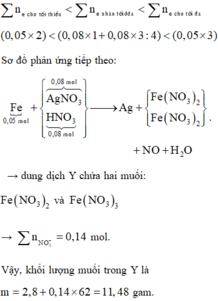

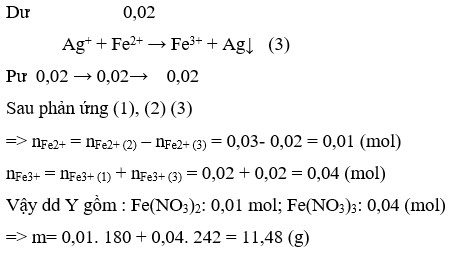


► Xét phản ứng điện phân: 4AgNO3 + 2H2O → 4Ag↓ + O2↑ + 4HNO3.
Đặt nO2 = x ⇒ nAg = 4x
⇒ mdung dịch giảm = 108 × 4x + 32x = 9,28(g)
⇒ x = 0,02 mol ⇒ Dung dịch X chứa AgNO3 và HNO3 đều 0,08 mol.
► Xét phản ứng Fe + dung dịch X:
nFe = 0,05 mol. Ta có:
4H+ + NO3– + 3e → NO + 2H2O
Ag+ + e → Ag↓ ⇒ ne = 0,14 mol.
● Do ne : nFe = 2,8 ⇒ Fe tan hết. Lại có: nNO3– = ne = 0,14 mol.
⇒ mmuối = mFe + mNO3 = 2,8 + 0,14 × 62 = 11,48(g)
Đáp án A