Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
∑ne trao đổi = 0,15 mol.
Vì 2nCu2+ > 0,15 ⇒ Cu2+ còn dư.
Vì nCl– < 0,15 ⇒ Ở Anot nước đã điện phân: 2H2O → O2 + 4H+ + 4e.
⇒ Trong dung dịch sau điện phân chứa: Cu(NO3)2 dư , KNO3 và HNO3 ⇒ Chọn B.

Đáp án B.
* Giả sử ở catot điện phân hết Cu2+

* Giả sử ở anot chỉ có Cl- bị điện phân hết, H2O chưa bị điện phân
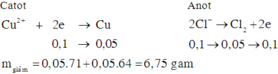
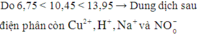

Đáp án A
Nhận thấy dung dịch Y làm quỳ tím hóa xanh → Y chứa OH- và bên catot xảy ra quá trình điện phân Cu2+, H2O bên anot mới điện phân xong hết Cl-
Khi cho Y tác dụng với AgNO3 thu được kết tủa là Ag2O : 0,01 mol
→ nOH- = nAg+ = 0,02 mol → nH2 = 0,01 mol
Chú ý khối lượng dung dịch giảm gồm Cu : y mol, H2 : 0,01 mol, Cl2 : 0,5x mol
Khi đó có hệ
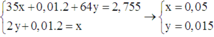
→ x : y = 10 : 3

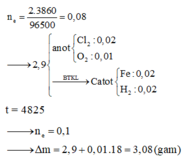
Đáp án D
Ta có ∑ne trao đổi = 0,2 mol
Ở Catot: 2H2O +2e → H2↑ + 2OH–
⇒ nH2↑ = 0,1 mol và nOH– sinh ra = 0,2 mol.
Ở anot: 2Cl– → Cl2↑ + 2e
+ Sau khi dừng điện phân có phản ứng: Mg2+ + 2OH– → Mg(OH)2↓
⇒ mDung dịch giảm = mH2↑ + mCl2↑ + mMg(OH)2↓
mDung dịch giảm = 0,1×2 + 0,1×71 + 0,1×58 = 13,1 gam



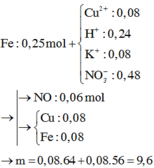
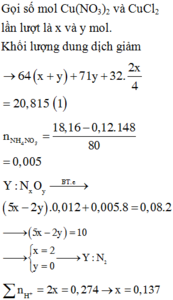
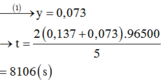
Đáp án A