Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

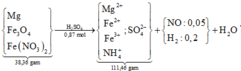
Sơ đồ quá trình + xử lí một số giả thiết cơ bản:

Giải khí nNO = 0,05 mol và nH2 = 0,2 mol. BTKL cả sơ đồ có nH2O = 0,57 mol.
Tiếp tục: bảo toàn H có nNH4+ = 0,05 mol
→ nFe(NO3)2 = 0,05 mol (theo bảo toàn N).
Bỏ cụm SO4 2 vế, tiến hành bảo toàn O có nFe3O4 = 0,08 mol.
Vậy mMg = 38,36 – 0,08 × 232 – 0,05 × 180 = 10,8 gam.
⇒ %mMg = 10 , 8 38 , 36 × 100 ≈ 28,15%
Đáp án D


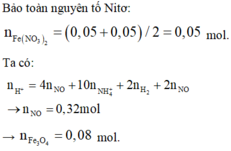
⇒ mMg = 38,36 – 0,05 × 180 – 0,08 × 232 = 10,8 gam
⇒ %mMg = 10,8 ÷ 38,36 × 100% = 28,15%
Đáp án A

Đáp án A
- 2 khí gồm H2 (không màu) và NO (không màu háo nâu trong không khí)
- Áp dụng qui tắc đường chéo :
=> Hỗn hợp X gồm 0,2 mol H2 và 0,05 mol NO
- Bảo toàn khối lượng : mR + mH2SO4 = mmuối + mX + mH2O
=> nH2O = 0,57 mol
- Xét dung dịch muối và hỗn hợp R có :
Bảo toàn H : 2nH2SO4 = 2nH2 + 2nH2O + 4nNH4
=> nNH4 = 0,05 mol
Bảo toàn N : nFe(NO3)2 = ½ (nNH4 + nNO) = 0,05 mol
Ta có : nH+ = 2nH2SO4 = 2nH2 + 4nNO + 10nNH4 + 2nO
=> nO(Oxit) = 0,32 mol
=> nFe3O4 = 0,08 mol
=> %mMg = 28,15%

Đáp án B
Sơ đồ quá trình phản ứng:
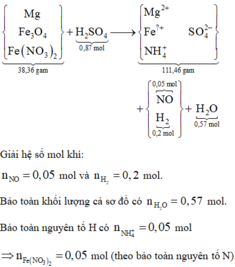
Bỏ cụm SO4 ở hai vế sơ đồ rồi tiến hành bảo toàn nguyên tố O ta có n Fe 3 O 4 = 0,08 mol.


Đáp án D
X gồm NO (x mol) và H2 (y mol)
x+y=0,25
20x+2y=0,25.3,8.2
=>x=0,05; y=0,2
BTKL: mR+mH2SO4=m muối+mNO+mH2+mH2O
=>mH2O=38,36+0,87.98-111,46-0,05.30-0,2.2=10,26 gam=>nH2O=0,57 mol
BTNT H: 2nH2SO4=4nNH4++2nH2+2nH2O=>nNH4+=(0,87.2-0,57.2-0,2.2)/4=0,05 mol
BTNT N: nNO3-=nNH4++nNO=0,05+0,05=0,1 mol=>nFe(NO3)2=0,05 mol
Giả sử Mg (a mol), Fe3O4 (b mol)
Dung dịch muối gồm: ion KL, 0,05 mol NH4+, 0,87 mol SO4 2-
24a+232b+0,05.180=38,36
24a+56(3b+0,05)=111,46-0,05.18-0,87.96 (KL ion KL)
=>a=0,45;b=0,08
%mFe3O4=232.0,08/38,36=48,38%

Đáp án A
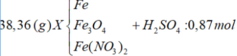
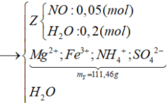
nZ = 5,6 : 22,4 = 0,25 (mol);
MZ = 3,8.2 = 7,6 (g/mol)
=> mZ = 0,25. 7,6 = 1,9 (g)
Gọi x và y là số mol của NO và H2
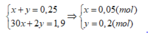
BTKL: mX + mH2SO4 = mY + mZ + mH2O
=> mH2O = 38,36 + 0,87.98 – 111,46 – 1,9 = 10,26 (g)
=> nH2O = 0,57 (mol)
BTNT H
nNH4+ = (2nH2SO4 – 2nH2 – 2nH2O )/4
= (2.0,87 – 2.0,2 – 2. 0,57)/4 = 0,05 (mol)
BTNT N:
nFe(NO3)2 = ( nNO + nNH4+)/2
( 0,05+ 0,05)/2 = 0,05 (mol)
BTNT O:
4nFe3O4 + 6nFe(NO3)2 = nNO + nH2O
=> nFe3O4 = ( 0,05 + 0,57 – 6. 0,05)/4 = 0,08 (mol)
BTKL:
mMg = mX – mFe3O4 – mFe(NO3)2
= 38,36 – 0,08.232 – 0,05. 180 = 10,8 (g)
%Mg = (10,8 : 38,36).100% = 28,15%

2 khí là NO và H2. Dễ tính NO = 0.1; H2 = 0.075
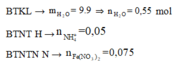
BTNT O →nZnO= 0.2
Đặt nMg = a; nAl =b.
Lập hệ → %nMg = 32%
Đáp án D

Chọn đáp án D.
Khí hóa nâu ngoài không khí là NO.


Gần với giá trị 30 nhất.

Đáp án D
Khí hóa nâu ngoài không khí là NO.
![]() => Khí còn lại có phân tử khối < 18 => Khí còn lại là H2.
=> Khí còn lại có phân tử khối < 18 => Khí còn lại là H2.
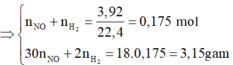
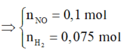
· Áp dụng bảo toàn khối lượng có:
![]()
![]()
Có:
![]()
=> Chứng tỏ có sản phẩm N H 4 + :
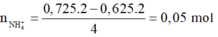
· Áp dụng bảo toàn N có: n F e ( N O 3 ) 2
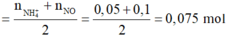
· Áp dụng bảo toàn nguyên tố O có:
![]()
![]()
· Đặt số mol của Mg, Al lần lượt là a, b
![]()
= 8,85
Vì có sản phẩm H2 tạo thành nên sau phản ứng Fe vẫn ở dạng Fe (II).
Áp dụng bảo toàn electron có:
![]()
![]()
Suy ra
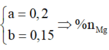
=> 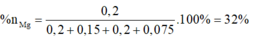
Gần với giá trị 30 nhất.
Đáp án D
Chú ý:
Tạo muối NH4+