Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Hiện tượng :
- Viên kẽm tan dần trong dd HCl loãng, có khí không màu thoát ra.
- Dấu hiệu chứng tỏ có phản ứng hoá học giữa HCl và Zn là mẩu Zn tan dần, có khí thoát ra.

- Học sinh tiến hành thí nghiệm, ghi giá trị mA và mB. Hiện tượng thí nghiệm: Xuất hiện kết tủa trắng.
- Ta có mA = mB.
Nhận xét: tổng khối lượng của các chất trước phản ứng bằng tổng khối lượng của các chất sau phản ứng.

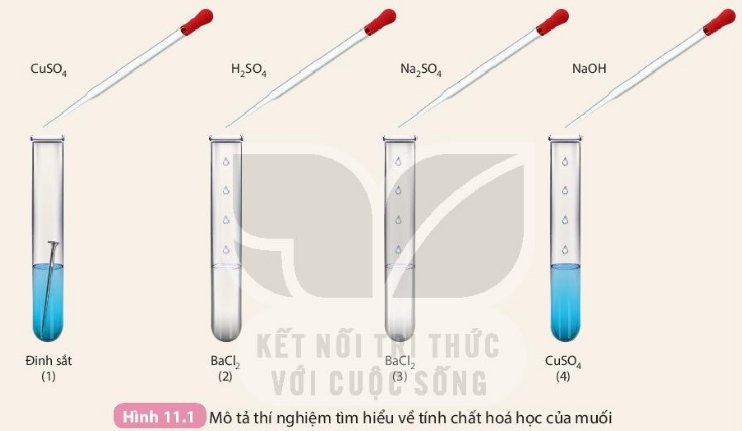
Câu 1:
\(Fe+CuSO_4\rightarrow FeSO_4+Cu\\ BaCl_2+H_2SO_4\rightarrow BaSO_4+2HCl\\ BaCl_2+Na_2SO_4\rightarrow BaSO_4+2NaCl\\ CuSO_4+2NaOH\rightarrow Cu\left(OH\right)_2+Na_2SO_4\)
Câu 2:
TCHH của muối:
- Bị khử bởi một số kim loại.
- Tác dụng với một số dung dịch acid tạo muối mới và acid mới
- Tác dụng với một số dung dịch muối tạo 2 muối mới
- Tác dụng với một số dung dịch base tạo dung dịch muối mới và base mới

Hiện tượng: Các kim loại tan trong dung dịch acid, có sủi bọt khí, quỳ tím hoá đỏ.
PTHH:
\(Fe+2HCl\rightarrow FeCl_2+H_2\\ Zn+2HCl\rightarrow ZnCl_2+H_2\)

Hiện tượng: Dung dịch NaOH chuyển sang màu hồng, dung dịch HCl không thay đổi màu sắc.
Giải thích: dd NaOH có tính base bị phenolphthalein làm dung dịch base chuyển sang màu hồng nhạt, dung dịch HCl có tính acid không có tính chất làm chuyển màu dung dịch nhờ phenolphthalein nên giữ được màu sắc ban đầu.

PTHH: CuSO4 + 2NaOH -> Cu(OH)2 + Na2SO4
Hiện tượng: Dung dịch CuSO4 mất màu xanh, có kết tủa xanh lam sau phản ứng
Giải thích: ion Cu2+ có tác dụng với ion OH- tạo kết tủa xanh lam Cu(OH)2

PTHH: BaCl2 + H2SO4 -> BaSO4 (kt trắng) + 2HCl
Mô tả hiện tượng: Có kết tủa trắng tạo thành sau phản ứng.
Giải thích: BaCl2 tác dụng với H2SO4 theo tính chất của muối và axit, tạo muối BaSO4 không tan (kết tủa trắng) và dung dịch HCl.

PTHH: Na2CO3 + CaCl2 -> CaCO3 (kết tủa trắng) + 2NaCl
Hiện tượng: Có kết tủa trắng sau phản ứng.
Giải thích: Na2CO3 tác dụng với CaCl2 tạo muối CaCO3 không tan (kt trắng) và dd NaCl.

1. Dung dịch kiềm làm đổi màu giấy quỳ tím thành màu xanh, đổi màu dung dịch phenolphthalein thành màu hồng.
2. Hiện tượng xảy ra ở thí nghiệm 2: Ban đầu hỗn hợp trong ống nghiệm có màu hồng, sau khi nhỏ từ từ HCl vào hỗn hợp nhạt màu dần đến mất màu.
Nhận xét: Dung dịch kiềm phản ứng được với dung dịch acid. (Tính chất cơ bản)




Ống nghiệm (1) và (3) xảy ra phản ứng hoá học do có những dấu hiệu nhận ra có chất mới tạo thành. Cụ thể:
+ Ống nghiệm (1) viên kẽm tan dần, có khí không màu thoát ra.
+ Ống nghiệm (3) có kết tủa xanh tạo thành.