Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Phương trình hóa học của phản ứng:
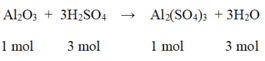
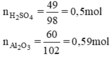
So sánh tỉ lệ 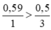 → Vậy Al2O3 dư
→ Vậy Al2O3 dư
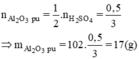
mAl2O3 (dư) = 60 - 17 = 43(g)

a. 2Al + 3H2SO4 → Al2(SO4)3 + 3H2
b. nH2SO4 =\(\dfrac{29,4}{98}\)=0,3 mol
Theo phương trình ta có số mol nhôm đã phản ứng là nAl= \(\dfrac{0,3.2}{3}\)= 0,1 mol ==> a = 0,1.27 = 2,7 gam
c. Phản ứng vừa đủ nên cả Al và H2SO4 cùng hết , không có chất nào dư sau phản ứng

2Al+3H2SO4->Al2(SO4)3+3H2
0,1----------------------0,075----0,15
n H2=0,15 mol
=>mAl=0,1.27=2,7g
=>m Al2(SO4)3=0,075.342=25,65g
a) PTHH: \(2Al+3H_2SO_2\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
b) \(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
\(n_{Al}=\dfrac{2}{3}.0,15=0,1\left(mol\right)\)
\(m_{Al}=0,1.27=2,7\left(g\right)\)
c) \(n_{Al_2\left(SO_4\right)_3}=\dfrac{1}{2}.0,1=0,05\left(mol\right)\)
\(m_{Al_2\left(SO_4\right)_3}=0,05.342=17,1\left(g\right)\)

\(n_{Al}=\dfrac{2.7}{27}=0.1\left(mol\right)\)
\(n_{CuSO_4}=0.6\cdot0.1=0.06\left(mol\right)\)
\(2Al+3CuSO_4\rightarrow Al_2\left(SO_4\right)_3+3Cu\)
\(2............3\)
\(0.1.........0.06\)
\(LTL:\dfrac{0.1}{2}>\dfrac{0.06}{3}\Rightarrow Aldư\)
\(m_{Al\left(dư\right)}=\left(0.1-0.04\right)\cdot27=1.62\left(g\right)\)
\(C_{M_{Al_2\left(SO_4\right)_3}}=\dfrac{0.02}{0.1}=0.2\left(M\right)\)

ta có nhôm (Al) tác dụng với axit sunfuric (H2SO4) thu được khi hidro( h2) và hợp chất nhôm sunfat Al2(SO4)3 nên có phương trình hóa học: Al + H2SO4 -> H2 + Al2(SO4)3
theo định luật bảo tồn khối lượng ta có :
m Al + m H2SO4 = m H2+ m Al2(SO4)3
Câu cuối tính m mình chưa biết tính cái chi nên không tính được.
chúc bạn học tốt nhé

\(n_{H_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right);n_{Fe_2O_3}=\dfrac{16}{160}=0,1\left(mol\right)\\ a,PTHH:3H_2+Fe_2O_3\rightarrow\left(t^o\right)2Fe+3H_2O\\ b,Vì:\dfrac{0,4}{3}>\dfrac{0,1}{1}\Rightarrow H_2dư\\ n_{H_2\left(dư\right)}=0,4-3.0,1=0,1\left(mol\right)\\ c,Fe_2O_3+6HCl\rightarrow2FeCl_3+3H_2O\\ n_{FeCl_3}=2.0,1=0,2\left(mol\right)\\ m=m_{FeCl_3}=0,2.162,5=32,5\left(g\right)\)

`a)`
`Fe + H_2 SO_4 -> FeSO_4 + H_2`
`0,4` `0,4` `0,4` `(mol)`
`n_[Fe]=[22,4]/56=0,4(mol)`
`b)m_[FeSO_4]=0,4.152=60,8(g)`
`c)V_[H_2]=0,4.22,4=8,96(l)`

\(a) Zn + H_2SO_4 \to ZnSO_4 + H_2\\ n_{Zn} = \dfrac{13}{65} = 0,2 < n_{H_2SO_4} = \dfrac{200.24,5\%}{98} = 0,5 \to H_2SO_4\ dư\\ n_{H_2SO_4\ pư} =n_{Zn} = 0,2(mol)\\ \Rightarrow m_{H_2SO_4\ dư} = (0,5 - 0,2).98 = 29,4(gam)\\ c) n_{FeSO_4} = n_{H_2} = n_{Zn} = 0,2(mol)\\ m_{FeSO_4} = 0,2.152 = 30,4(gam)\\ V_{H_2} = 0,2.22,4 = 4,48(lít)\)
1. Fe2O3 + 3H2SO4 --> Fe2(SO4)3 + 3H2O
2. nFe2O3= 5/160=1/32 mol
nH2SO4= 0.075 mol
Lập tỉ lệ: 1/32 > 0.075/3 => Fe2O3 dư
nFe2O3 dư= 1/32 - 0.075/3= 1/160 mol
mFe2O3 dư= 1/160*160=1 g
3. nFe2(SO4)3= 0.075/3=1/40 mol
mFe2(SO4)3= 1/40*400=10g
Phương trình hóa học:
Fe2O3 + 3H2SO4 => Fe2(SO4)3 + 3H2O
nFe2O3 = m/M = 5/160 =1/32 (mol);
nH2SO4= 0.075 (mol)
Lập tỉ số: 1/32 > 0.075/3 => Fe2O3 dư, H2SO4 hết
nFe2O3 dư = 1/32 - 0.075/3= 1/160 (mol) mFe2O3 dư = n.M = 1/160x160 = 1
nFe2(SO4)3 = 0.075/3 =1/40 (mol)
mFe2(SO4)3 = n.M = 10 (g)