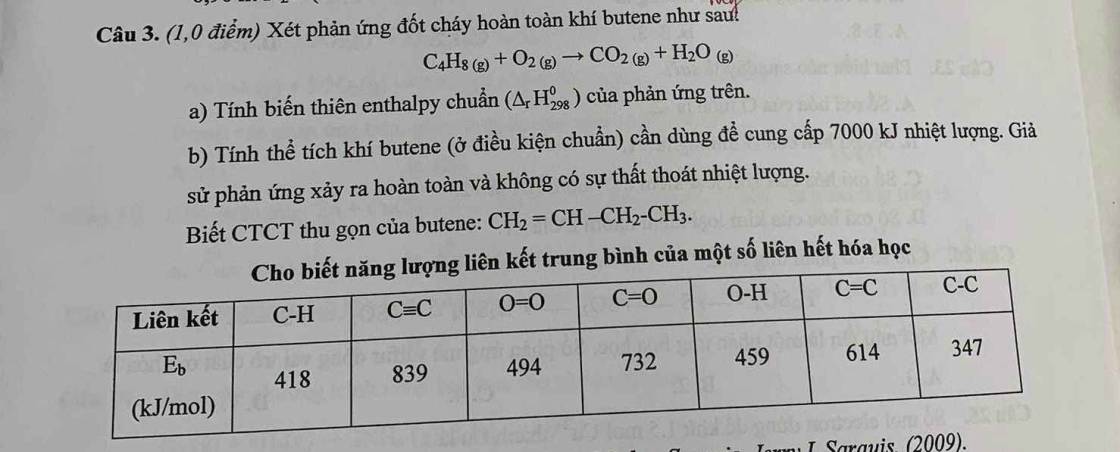
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.




MgO: Mg có điện hóa trị 2+, O có điện hóa trị 2-
FeF3: Fe có điện hóa trị 3+, F có điện hóa trị 1-
BaCl2: Ba có điện hóa trị 2+, Cl có điện hóa trị 1-
Ca3N2: Ca có điện hóa trị 2+, N có điện hóa trị 3-

* Chứng minh công thức phụ : \(\dfrac{S}{3,5}\) \(\leq\) P \(\leq\) \(\dfrac{S}{3}\) từ công thức 1 \(\leq\) \(\dfrac{N}{P}\) \(\leq\) 1,5
(Trong đó S = 2P+N)
Ta có : NO = 16 - 8 = 8
-> SO = 2.8 + 8 =24
Gọi số proton và notron của R là P và N
Xét phân tử RO2 có tổng số hạt = (2P + N) + 2 . 24 = 66
\(\Leftrightarrow\) 2P + N = 18 = S
Thay S = 18 vào công thức phụ ở trên , suy ra được : 5,14 \(\le\) P \(\le\) 6
mà P \(\in\) Z nên P = 6 , suy ra R là Cacbon ( số hiệu nguyên tử là 6)

Bạn hãy tính số mol của NaOH và H2SO4 trước rồi sau đó chia nhau ra tỉ lệ k rồi so sánh ra muối nếu k<1 là muối axit , 1<k<2 là muối axit và muối trung hòa, k>2 là muối trung hòa.
Hướng dẫn nè:
\(n_{H_2SO_4}=\frac{9,8}{2+32+16.4}=0,1\left(mol\right)\)
\(n_{NaOH}=C_{M_{NaOH}}.V_{ddNaOH}=1.0,15=0,15\left(mol\right)\left(Vdd=150ml=0,15l\right)\)
k=\(\frac{n_{NaOH}}{n_{H_2SO_4}}=\frac{0,15}{0.1}=1,5\)(1<1,5<2)
=> 2 muối là Na2SO4(muối trung hòa) và NaHSO4(muối axit)

\(Ba\rightarrow Ba^{2+}+2e\\ K\rightarrow K^++e\\ O+2e\rightarrow O^{2-}\\ N\rightarrow N^{5+}+5e\)









Ta có :
\(\dfrac{34}{3,2222}\) \(\le\) p \(\le\) \(\dfrac{34}{3}\)
\(\Leftrightarrow\) 10,5 \(\le\) p \(\le\) 11,3
\(\Rightarrow\) Chọn p = 11
\(\Rightarrow\) p =e =11 . n = 34 - 11 - 11 =12
A = p+n = 11+12 =23