Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C

- Giả sử Mg, Fe đều phản ứng hết với muối kim loại => Z chứa toàn bộ số mol Mg2+ ; Fex+
=> T chứa Mg(OH)2 và Fe(OH)x => Chất rắn cuối cùng là MgO và Fe2O3 chắc chắn phải có khối lượng lớn hơn lượng kim loại ban đầu trong X => Không thỏa mãn đề bài (7,2 < 7,36)
=> Các muối nitrat phản ứng hết, kim loại dư và đó là Fe (vì Mg phản ứng trước)
=> kết tủa Y gồm Cu, Ag, Fe.
- Gọi nMg = a ; nFe(pứ) = b ; nFe dư = c => mX = 24a + 56b + 56c = 7,36 (1)
- Bảo toàn e cho phản ứng trao đổi muối: 2nMg + 2nFe pứ = nAg + 2nCu = 2a + 2b
- Khi Y + H2SO4 đặc nóng (Fe → Fe3+)
Bảo toàn electron: 2nCu + nAg + 3nFe dư = 2nSO2 = 2.5,04/22,4 = 0,45 mol
=> 2a + 2b + 3c = 0,45 (2)
- Như đã phân tích ở trên. chất rắn cuối cùng gồm MgO và Fe2O3.
Bảo toàn nguyên tố: nMg = nMgO = a ; nFe2O3 = ½ nFe pứ = 0,5b
=> mrắn = mMgO + mFe2O3 = 40a + 160.0,5b = 40a + 80b = 7,2 (3)
Từ (1,2,3) => a = 0,12 ; b = 0,03 ; c = 0,05 mol
=> mFe(X) = 56.(0,03 + 0,05) = 4,48g
=> %mFe(X) = 4,48: 7,36 = 60,87%

Đáp án C
- Thêm AgNO3 vào Y thấy tạo thêm NO chứng tỏ Y chứa Fe2+, H+ dư và không còn NO3-
=> Y + AgNO3 có phản ứng:
Ag+ + Cl- → AgCl
Ag+ + Fe2+ → Ag + Fe3+
Bảo toàn nguyên tố Cl: nAgCl = nCl = 0,3 mol
Có: mtủa = mAg + mAgCl => mAg = 44,022 – 143,5.0,3 = 0,972 g
=> nAg = 0,009 mol
Bảo toàn electron: nFe2+ = 3nNO + nAg = 3.0,009 + 0,009 = 0,036 mol
nH+ dư = 4nNO = 0,036 mol
Vậy dung dịch Y chứa Fe2+(0,036 mol) ; H+ (0,036 mol) ; Cl- (0,3 mol) và Fe3+
Bảo toàn điện tích: 2nFe2+ + 3nFe3+ + nH+ = nCl- => nFe3+ = 0,064 mol
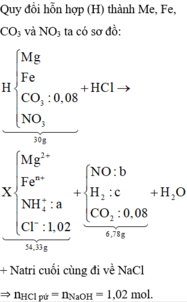
Đặt số mol Fe, Fe3O4, Fe(NO3)2 lần lượt là a, b, c.
Có: mX = 56a + 232b + 180c = 7,488 (1)
Bảo toàn Fe: nFe = a + 3b + c = nFe2+ + nFe3+ = 0,1 mol(2)
nH+ pứ = nHCl bđ + nHNO3 – nH+(Y) = 0,3 + 0,024 – 0,036 = 0,288 mol
Bảo toàn H: nH2O = ½ nH+ pứ = 0,144 mol
Bảo toàn O: 4nFe3O4 + 6nFe(NO3)2 + 3nHNO3 = nH2O + nNO + nN2O
=> 4b + 6c = 0,104 mol(3)
Từ (1,2,3) => a = 0,05 ; b = 0,014 ; c = 0,008
=> %mFe = 56.0,05/7,488 = 37,4% (Gần nhất với giá trị 37,8%)

Đáp án : A
Ta thấy mX > mRắn (gồm oxit) => Y gồm cả Fe , Cu , Ag
Gọi số mol Mg là x ; số mol Fe phản ứng đầu là y và dư sau đó là z mol
=> mX = 24x + 56y + 56z = 7,36g (1)
Bảo toàn e : 2nMg + 2nFe pứ + 3nFe dư = nAg + 2nCu + 3nFe dư = 2nSO2
=> 2x + 2y + 3z = 0,45 mol
,mrắn = mMgO + mFe2O3 = 40x + 80y = 7,2g
=> x = 0,12 mol ; y = 0,03 mol ; z = 0,05 mol
=> %mFe(X) = 60,87%


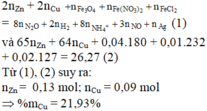
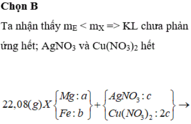
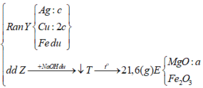
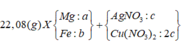
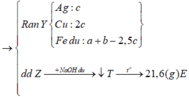
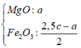
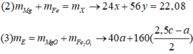
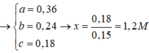
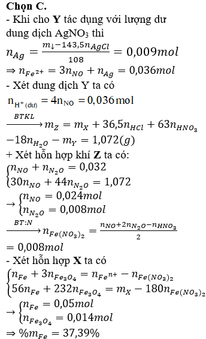



Đáp án C
Ta có: nCu(NO3)2 = 0 , 2 m o l ; n A g N O 3 = 0 , 1 m o l
Ta có: 0,2.64 + 0,1.108 = 23,6 < 24,16 chứng tỏ Cu(NO3)2 và AgNO3 hết, còn kim loại dư.
Dung dịch Y tác dụng với HCl dư thu được 0,01 mol NO chứng tỏ Y chứa 0,03 mol Fe(NO3)2.
Bảo toàn điện tích: n Mg (NO 3 ) 2 = 0 , 2 . 2 + 0 , 1 - 0 , 03 . 2 2 = 0 , 22 m o l
Mặt khác do Y chứa Fe(NO3)2 nên kim loại chỉ có Fe dư và khối lượng Fe dư là 0,56 gam.
→ m x = 0 , 56 + 0 , 03 . 56 + 0 , 22 . 24 = 7 , 52 → %Fe = 29,79%