Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Giải thích: Đáp án B
m(hh Y) = mCu + mAg = 64 . nCu + 108 . nAg = 14 (1)
Cho Y + H2SO4:
Số mol e trao đổi = 2nCu + 1nAg = 2nSO2 = 2.0,1 = 0,2 (2)
Giải (1) và (2) : nAg = 0,1 mol; nCu = 0,05 mol
Theo bài cho nồng độ Cu(NO3)2 gấp 2 lần AgNO3 như vậy lượng Cu(NO3)2vẫn còn dư sau phản ứng.
→ kết quả trên là hợp lí, hỗn hợp Mg, Al đã phản ứng hết với Ag+, đến lượt Cu2+ thì mới phản ứng được 0,05 mol thì hết, còn lại 0,15 mol dư.
Như vậy ta có nAgNO3 = nAg = 0,1 mol a = 0,1 mol

Đáp án B
Ta nhận thấy mE < mX => KL chưa phản ứng hết; AgNO3 và Cu(NO3)2 hết
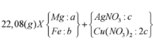
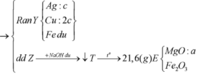
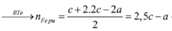
![]()

Đáp án C
Xét phần 1: quy Y về Fe, Cr, Al và O ![]()
-Xét phần 2: bảo toàn nguyên tố Hidro: ![]()
=> bảo toàn nguyên tố Oxi:
![]()
Quay lại phần 1, bảo toàn electron: ![]()
Xét phần 2: bảo toàn khối lượng: ![]()
Lại có: ![]() đều phản ứng với NaOH theo dạng:
đều phản ứng với NaOH theo dạng:
![]()
![]()
= (0,04 + 2a) mol
Bảo toàn nguyên tố Al và Cr: ![]()
Bảo toàn nguyên tố Natri: ![]()
Bảo toàn khối lượng:![]()
![]()
![]()
![]()
![]()

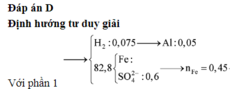
Xét phần 1: do sinh ra H2 ⇒ Al dư. nH2 = 0,075 mol ⇒ nAl dư = 0,05 mol.
Rắn không tan là Fe. Ta có: 2H2SO4 + 2e → SO2 + SO42– + 2H2O.
⇒ nSO42– = nSO2 = 0,6 mol ⇒ nFe = (82,8 – 0,6 × 96) ÷ 56 = 0,45 mol.
8Al + 3Fe3O4 → 4Al2O3 + 9Fe ⇒ nAl2O3 = 0,45 × 4 ÷ 9 = 0,2 mol.
⇒ mphần 1 = 0,05 × 27 + 0,2 × 102 + 0,45 × 56 = 46,95(g) ⇒ m phần 2 = 187,8(g).
⇒ phần 2 gấp 4 lần phần 1 ⇒ phần 2 chứa 0,2 mol Al; 0,8 mol Al2O3; 1,8 mol Fe.
Ta có: nH+ = 4nNO + 2nNO2 + 2nO + 10nNH4+ ⇒ nNH4+ = 0,015 mol.
Đặt nFe(NO3)2 = b ⇒ a + b = nFe = 1,8 mol; Bảo toàn electron:
0,2 × 3 + 3a + 2b = 1,25 × 3 + 1,51 + 0,015 × 8. Giải hệ có: a = 1,18.
Đáp án D

Giải thích:
Phần 1:
nH2 = 0,075 => nAldư = 0,05
8Al + 3Fe3O4 → 4Al2O3 + 9Fe
8x→ 3x →4x → 9x
Chất rắn không tan trong NaOH là Fe (9x mol). Với H2SO4 đặc nóng
=> Fe3+ (u) và Fe2+ (v)
Bảo toàn electron: 3u + 2v = 0,6 . 2
m muối = 400a/2 + 152b = 82,8
=> u = 0,3 và v = 0,15
=> 9x = u + v => x = 0,05
Vậy phần 1 chứa Al (0,05), Al2O3 (0,2) và Fe (0,45)
=> mPhần 1 = 46,95
=> mPhần 2 = mX - mPhần 1 = 187,8
=> mPhần 2 = 4mPhần 1
Vậy phần 2 chứa các chất có số mol gấp 4 phần 1.
Phần 2 chứa Al (0,2), Al2O3 (0,8) và Fe (1,8)
=> nO = 0,8 . 3 = 2,4
nH+ = 12,97 = 4nNO + 2nNO2 + 2nO + 10nNH4+
=> nNH4+ = 0,015
Dung dịch A chứa Fe3+ (a mol), Fe2+ (y mol) và các ion khác.
Bảo toàn Fe => a + b = 1,8
Bảo toàn electron => 3a + 2b + 0,2 . 3 = 1,25 . 3 + 1,51 + 0,015 . 8
=> a = 1,18 và b = 0,62
Đáp án D



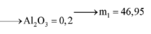
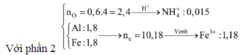
Đáp án D
Áp dụng bảo toàn electron có:
Trường hợp 1: Chất rắn chỉ có Ag
⇒ n Ag = 0 , 7 mol ⇒ m Ag = 75 , 6 gam > 45 , 2 => Loại
Trường hợp 2: Chất rắn có a mol Ag và 2a mol Cu
=> Loại =>Ag+ phản ứng hết, Cu2+ phản ứng còn dư