

Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



Đáp án A
nAl = 2,7 : 27 = 0,1 mol , nFe = 5,6 : 56 = 0,1 mol ,nAgNO3 = 0,55.1 = 0,55 mol
Khi cho hỗn hợp kim loại gồm Al , Fe vào dung dịch AgNO3 thì Al sẽ phản ứng trước nếu Al hết sẽ đến Fe phản ứng , nếu AgNO3 dư sau phản ứng với Fe thì có phản ứng:
Ag+ + Fe2+ → Ag + Fe3+
Al + 3AgNO3 à Al(NO3)3 + 3Ag (1)
Ban đầu 0,1 0,55
Phản ứng 0,1 0,3 0,3
Kết thúc 0 0,25 0,3
Al hết ⇒ Tính theo Al , = 3.nAl ⇒ AgNO3 dư : 0,55 – 3.0,1 = 0,25 mol
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag (2)
Ban đầu 0,1 0,25
Phản ứng 0,1 0,2 0,1 0,2
Kết thúc 0 0,05 0,1 0,2
⇒ Sau phản ứng AgNO3 dư : 0,05 mol tiếp tục có phản ứng
Fe(NO3)2 + AgNO3 → Fe(NO3)3 + Ag (3)
Ban đầu 0,1 0,05
Phản ứng 0,05 0,05 0,1
Kết thúc 0,05 0 0,1
Từ (1) , (2) , (3) tổng số mol Ag = 0,3+ 0,2 + 0,05 = 0,55 ⇒ mAg = 0,55.108 = 59,4 gam

Đáp án D
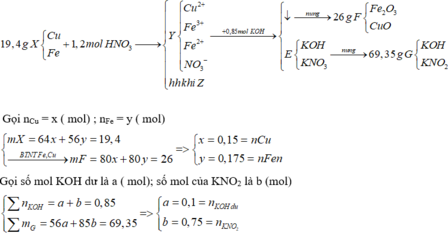
BTNT N => nN(trong Z) = nHNO3 – nNO3- = 1,2 – 0,75 = 0,45 (mol)
Ta thấy 3nFe + 2nCu = 0,875 > nNO3- = 0,75 => sản phẩm trong Y có cả Fe2+, Fe3+. HNO3 đã phản ứng hết
ne(nhường) = 3nFe3+ + 2nFe2+ + 2nCu2+ = nKOH pư = b = 0,75 (mol)
=> trung bình mỗi N+5 đã nhận 0,74/0,45 = 5/3 (electron)
=> NO2 : z ( mol) và NO: t (mol)
=> z + t = 0,45
=> Vhh Z = 0,45.22,4 = 10,08 (lít) gần nhất với 11,02 lít