Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

1/Bt(e); 3*nFe pư HNO3 = 3*nNO
- > nFe(3+) = 0,12 mol.
Fe +--- 2Fe(3+) -> 3Fe(2+)
0,03------0,06 mol.
nFe(3+) sau pư = 0,12 – 0,06 = 0,06 mol
2/nFeSO4 = 0,1 mol
BTE => 0,1 = 2x
=> nCl2 = 0,05 mol
m(muối) = mFeSO4 + mCl2 = 0,1.152 + 0,05.71 = 18,75 gam

Gọi \(n_{Fe\left(X\right)}=a\left(mol\right)\)
Ta có sơ đồ phản ứng:
\(Fe+O_2\xrightarrow[]{t^o}X\left\{{}\begin{matrix}Fe\\FeO\\Fe_3O_4\\Fe_2O_3\end{matrix}\right.\xrightarrow[]{+HNO_{3\left(lo\text{ãng},d\text{ư}\right)}}Fe\left(NO_3\right)_3+NO+H_2O\)
Đặt \(n_{Fe}=a\left(mol\right)\)
BTNT Fe: \(n_{Fe\left(NO_3\right)_3}=n_{Fe}=a\left(mol\right)\)
BTNT N: \(n_{HNO_3}=3n_{Fe\left(NO_3\right)_3}+n_{NO}=3a+0,06\left(mol\right)\)
BTNT H: \(n_{H_2O}=\dfrac{1}{2}n_{HNO_3}=1,5a+0,03\left(mol\right)\)
Áp dụng ĐLBTKL:
\(m_X+m_{HNO_3}=m_{Fe\left(NO_3\right)_3}+m_{NO}+m_{H_2O}\)
\(\Rightarrow11,36+63.\left(3a+0,06\right)=242a+0,06.30+18.\left(1,5a+0,03\right)\)
\(\Leftrightarrow a=0,16\left(mol\right)\)
\(\Rightarrow m=m_{Fe}=0,16.56=8,96\left(g\right)\)

2yAl +3FexOy -to-> 3xFe + yAl2O3 (1)
phần 1 : Fe +4HNO3 --> Fe(NO3)3 + NO +2H2O (2)
Al2O3 + 6HNO3 --> 2Al(NO3)3 +3H2O (3)
Al +4HNO3 --> Al(NO3)3 +NO +2H2O (4)
P2 : Al2O3 +2NaOH --> 2NaAlO2 +H2O (5)
2Al +2H2O +2NaOH --> 2NaAlO2 +3H2 (6)
vì khi cho phần 2 td vs NaOH dư thấy giải phóng H2 => Al dư sau (1)
nH2=0,015(mol)
nFe(P2)=0,045(mol)
giả sử P1 gấp k lần P2
=> nFe(P1)=0,045k(mol)
theo (5) : nAl(P2)=2/3nH2=0,01(mol)
=>nAl(P1)=0,01k(mol)
nNO=0,165(mol)
theo (2,4) :nNO=(0,045k+0,01k) (mol)
=>0,055k=0,165=> k=3
=>nAl(P1)=0,03(mol)
nFe(p1)=0,135(mol)
\(\Sigma nFe=0,045+0,135=0,18\left(mol\right)\)
\(\Sigma nAl=0,03+0,01=0,04\left(mol\right)\)
mAl2O3=\(14,49-0,135.56-0,03.27=6,12\left(g\right)\)
nAl2O3(P1)=0,06(mol)
=> nAl2O3(P2)=0,02(mol)
\(\Sigma nAl2O3=0,08\left(mol\right)\)
theo (1) : nFe=3x/ynAl2O3
=> 0,18=3x/y.0,08=> x/y=3/4
=>CTHH : Fe3O4
theo (1) :nFe3O4 =1/3nFe=0,06(mol)
=>m=0,04.27+0,06.232=15(g)
bạn Lê Đình Thái ơi bạn giải nhầm tìm m rồi. Cái 0,04 mol đó là mol dư, bạn phải cộng với 0,16 mol phản ứng khi xảy ra phản ứng nhiệt phân nữa.
Kết quả là m=0,2.27+0,06.232=19,32 gam

3FeS + 12HNO3 => Fe(NO3)3 +Fe2(SO4)3 + 9NO + 6H2O
0,04 ----> 0.03
V= 0,672
Vậy NO=0,672

\(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right);n_{SO_2}=\dfrac{10,08}{22,4}=0,45\left(mol\right)\)
PTHH:
Fe + 2HCl ---> FeCl2 + H2
0,2------------------------>0,2
\(2Fe+6H_2SO_{4\left(đ\right)}\xrightarrow[]{t^o}Fe_2\left(SO_4\right)_3+3SO_2+6H_2O\)
0,2---------------------------------------->0,3
\(Cu+2H_2SO_{4\left(đ\right)}\xrightarrow[]{t^o}CuSO_4+SO_2+2H_2O\)
0,15<--------------------------------0,15
=> \(\left\{{}\begin{matrix}\%m_{Fe}=\dfrac{0,2.56}{0,2.56+0,15.64}.100\%=53,85\%\\\%m_{Cu}=100\%-53,85\%=46,15\%\end{matrix}\right.\)

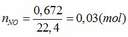
Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O (1)
a → 4a → a → a (mol)
3Fe + 8HNO3 → 3Fe(NO3)2 + 2NO + 4H2O (2)
B → 8/3b → b →2/3b (mol)
TH1: xảy ra phản ứng (1) tạo muối Fe(NO3)3 => nFe(NO3)3 = nNO = 0,03 (mol)
=> mmuối = mFe(NO3)3 = 0,03. 242 = 7,26 (g) # 7,82 => loại
TH2: xảy ra phản ứng (2) tạo muối Fe(NO3)2 => nFe(NO3)2 = 3/2 nNO = 3/2 . 0,03 = 0,045 (mol)
=> mmuối = mFe(NO3)2 = 0,045. 180 = 8,1 (g) # 7,82 => loại
TH3: xảy ra cả (1) và (2) phản ứng tạo 2 muối.
Gọi số mol của Fe ở phản ứng (1) và (2) lần lượt là a và b (mol)
Đặt vào phương trình ta có:
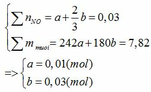
∑ nFe = 0,01 + 0,03 = 0,04 (mol) => mFe = 0,04.56 = 2,24 (g)
∑ nHNO3 pư = 4a + 8/3b = 4. 0,01 + 8/3. 0,03 = 0,12 (mol)
mHNO3 = 0,12.63 = 7,56 (g)
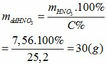
Khối lượng dd sau: mdd sau = mFe + mddHNO3 - mNO = 2,24 + 30 – 0,03.30 = 31,34 (g)
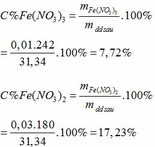
Okay, mình đã hiểu ý hỏi của em! Em chú ý nhé!
Cho sắt dư vào, sắt dư sẽ tác dụng với dd H2SO4 tạo khí hidro và muối sắt (II) trước. Lượng dư sắt này lại tác dụng với muối sắt (III) khử nó thành sắt (II) Fe(NO3)2 . Muối sắt (II) này tác dụng với dd H2SO4 còn dư tạo ra FeSO4 và dung dịch HNO3. Lượng sắt dư thì lại tác dụng với dd HNO3 tạo khí NO.
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\uparrow\\ 2Fe\left(NO_3\right)_3+Fe_{d\text{ư}}\rightarrow3Fe\left(NO_3\right)_2\\ Fe\left(NO_3\right)_2+H_2SO_4\rightarrow FeSO_4+2HNO_3\\ Fe_{d\text{ư}}+4HNO_3\rightarrow Fe\left(NO_3\right)_3+NO\uparrow+2H_2O\)
cảm ơn anh đã tận tình chỉ. nhưng câu trả lời của anh sai hoàn toàn rồi nhé! và ko biết anh lớn hơn em bao nhiêu và có BDHSG hóa ko. nhưng mong anh tìm hiểu lại phản ứng trao đổi. hơn cả bài này nếu viết như anh không bao giờ giải ra đáp án một bài toán nào cả vì bản chất pt đã sai hoàn toàn