Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Ta có: \(1\le\dfrac{N}{Z}\le1,5\)
\(\Rightarrow Z\le N\le1,5Z\)
\(\Rightarrow3Z\le2Z+N\le3,5Z\)
Vậy ta có : \(3Z\le24\le3,5Z\)
=> \(6,86\le Z\le8\)
=>\(\left[{}\begin{matrix}Z=7\left(N\right)\\Z=8\left(O\right)\end{matrix}\right.\Rightarrow\left[{}\begin{matrix}N=10\\N=8\end{matrix}\right.\)
Mà theo đề bài : \(1\le\dfrac{N}{Z}\le1,5\)
=> Chỉ có O thỏa mãn
=> Z là O , số P= số E =8 , N=8
b) Cấu hình E: 1s22s22p4

ta co p+e+n=93 mà p=e=z => 2z+n=93
2z-n=23 ( vì số hạt mang điện nhiều hơn số hạt ko mang điện là 23)
tu 2 pt trên ta có z =29,,n=35
=> số hiệu nguyên tử của B = Z = 29
cấu hình electron
\(1s^22s^22p^63s^23p^64s^23d^9\)
đối với các dạng bài này , bạn cần nhớ kiến thức như sau :
Tổng số hạt trong nguyên tử = 2p + n ( gồm có 3 loại hạt : n , p, e trong đó p=e)
số hạt mang điện là 2p
số hạt không mang điện là n
số hiệu nguyên tử là Z= p = e = số thứ tự nhóm .
Sau khi xác định được p ,, tức là cũng xác định được e thì
cấu hình viết theo dãy trật tự các mức năng lượng
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10.......
Các nguyên tử có 1, 2, 3e ở lớp ngoài cùng là các nguyên tử kim loại, trừ H, He và B.Các nguyên tử có 5, 6, 7e ở lớp ngoài cùng thường là các nguyên tố phi kim. Các nguyên tử có 4e ở lớp ngoài cùng có thể là nguyên tử kim loại hoặc phi kim

Đáp án C.
Tổng số hạt trong phân tử Y là 214 hạt.
4(2pM + nM) + 3(2pX + nX) = 214 (1)
Ion M3+ có số electron bằng số electron của ion X4 −
pM - 3 = pX + 4 => pX = pM - 7 (2)
Tổng số hạt proton, nơtron, electron của nguyên tử nguyên tố M nhiều hơn tổng số hạt của nguyên tử nguyên tố X trong Y là 106
4(2pM + nM) - 3(2pX + nX) = 106 (3)
(1), (3) => 2pM + nM = 40 (4) và 2pX + nX = 18 (5)
(5),(2),(4) => pX = 6 ; pM = 13 => X là C (Carbon) và M là Al (Nhôm)
Y la Al4C3 (Nhôm carbua)

Đáp án A
Cách 1: Theo giả thiết ta có:
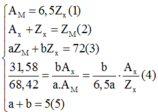
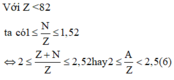
Từ (4) và (6) ta suy ra: 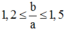
Chỉ có cặp a = 2 và b = 3 thỏa mãn
hợp chất là MaXb là M2X3
Thay vào ngược lại ta có:
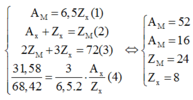
=> Hợp chất cần tìm là Cr2O3
Cách 2: X chiếm 31,58% về khối lượng:
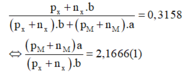
Theo giải thiết ta có
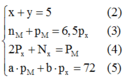
Quan sát – phân tích: Để tìm câu trả lời cho bài toán ta chỉ cần xác định được 4 ẩn x ; y; pM; pR. Vì vậy ta sẽ tìm cách khử các ẩn không cần thiết bằng cách thế phương trình (3) và (4) phương trình (1):
Thế (3) và (4) vào phương trình (1) ta được:
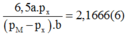
Phương án 1: Biện luận nghiệm theo giá trị của a và b:
Ta còn lại 3 phương trình với 4 ẩn số
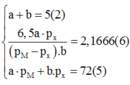
Nhận xét: Ở phương trình (6) chứa ẩn apX và bpM nhưng phương trình 5 lại không chứa 2 ẩn đó. Vì vậy ta không thể đưa ba phương trình trên về phương trình hai ẩn để biện luận. Điều duy nhất chúng ta có thể làm là phải biện luận cùng lúc 2 giá trị của a và b
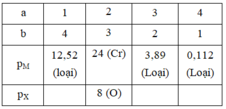
Vậy M là Crom và X là Oxi.
Phương án 2:
Biện luận tìm giá trị của a và b từ đó tìm M và X.
Từ phương trình (4) ta có
![]()
Mặt khác ta có với một nguyên tố có Z < 82 ta có:
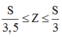
![]()
Từ (6); (7) và (8) ta suy ra: ![]()
=> chỉ có a = 2 và b = 3 là thỏa mãn
Ta tìm được M là Crom và X là Oxi.
Vậy hợp chất cần tìm là Cr2O3.
=> Tổng số hạt cơ bản là 224
Nhận xét: Đây là một trong những bài tập khó đòi hỏi tư duy và kĩ năng tính toán cao nhưng đối với những bạn có nhiều kinh nghiệm thì với bài tập này hoàn toàn có thể đoán được. Khi đề cho a + b = 5 thì với kinh nghiệm tích lũy trong quá trình học thì chúng ta sẽ đoán cặp số ở đây sẽ là 2 và 3 hợp chất đó sẽ là M2X3 thông thường thì đây sẽ là oxit của kim loại hóa trị 3 thay ngay Oxi vào tìm ra được M một cách nhanh chóng. Vì vậy kinh nghiệm đoán và bắt bài là một trong những kĩ năng rất cần thiết giúp ta giải quyết nhanh những bài toán hóa học khó.
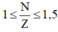
Đáp án B