Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C
Fe + ddZ → khí NO => X chứa H N O 3 dư. Quy X về Fe và O
Trong X, đặt ![]()
Bảo toàn electron:
![]()
Giải hệ có: x = 0,12 mol; y = 0,09 mol
Xét cả quá trình : do hòa tan tối đa Fe => Fe chỉ lên số oxi hóa +2.
Xét cả quá trình : do hòa tan tối đa Fe => Fe chỉ lên số oxi hóa +2.
![]()
![]()
![]()

Quy hỗn hợp về Fe và O với số mol lần lượt là a;b
$\Rightarrow 56a+16b=8,16$
Bảo toàn e ta được $3a-2b=0,06.3$
Giải hệ ta được $a=0,12;b=0,09$
Bảo toàn e cho phản ứng (2) ta có: $n_{NO}=0,02(mol)\Rightarrow n_{H^+/du}=0,08(mol)$
Dùng phương trình $H^+$ suy ra $n_{HNO_3}=0,5(mol)$
Coi hỗn hợp X gồm : Fe , O
\(n_{Fe}=a\left(mol\right),n_O=b\left(mol\right)\)
\(m_X=56a+16b=8.16\left(g\right)\left(1\right)\)
\(n_{NO}=\dfrac{1.344}{22.4}=0.06\left(mol\right)\)
\(\text{Bảo toàn e : }\)
\(3a=2b+3\cdot0.06\left(2\right)\)
\(\left(1\right),\left(2\right):a=0.12,b=0.09\)
\(\text{Bảo toàn e cho cả quá trình : }\)
\(2n_{Fe}=3n_{NO\left(1\right)}+2n_{NO\left(2\right)}\)
\(\Rightarrow n_{NO\left(2\right)}=0.08\)
\(n_{HNO_3}=0.5\left(mol\right)\)

Quy hỗn hợp về Fe và O với số mol lần lượt là a;b(mol)
$\Rightarrow 56a+16b=8,16$
Bảo toàn e ta được $3a-2b=0,06.3$
Giải hệ ta được $a=0,12'b=0,09$
Bảo toàn e cho phản ứng (2) ta có:
$n_{NO}=0,02(mol)\Rightarrow n_{H^+/dư}=0,08(mol)$
Dùng phương trình $H^+$ suy ra $n_{HNO_3}=0,5(mol)$

Đáp án C
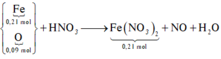
Bài toán nhỏ “cho 8,16 gam hỗn hợp X gồm Fe, FeO, Fe3O4 và Fe2O3 tan hết trong dung dịch HNO3 loãng (dung dịch Y) thu được 1,344 lít NO (đktc) và dung dịch Z” → đủ giả thiết
Quy đổi 8,16 gam X gồm x mol Fe và y mol O → 56x + 16y = 8,16
Do thêm Fe vào Z tiếp tục thu được NO → chứng tỏ HNO3 còn dư trong Z → muối Fe trong Z là muối Fe3+
Bảo toàn electron ta có: 3x = 2y + 0,06.3.
Kết hợp giải hệ được x = 0,12mol, y = 0,09mol
Hòa tan tối đa Fe nên dung dịch sản phẩm cuối cùng chỉ chứa muối sắt II
Gộp cả quá trình → quan sát:
Bảo toàn electron có nNO = (0,21.2 – 0,09.2) : 3 = 0,08mol
Bảo toàn nguyên tố N có số mol HNO3 là 0,08 + 0,21.2 = 0,5mol



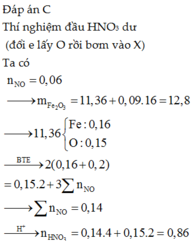
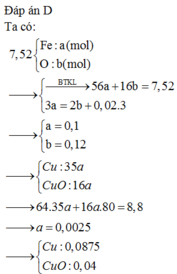

Số mol HNO3 có trong Y là
A. 0,54 mol. B. 0,78 mol. C. 0,50 mol. D. 0,44 mol.
Đây là câu khá kinh điển, nhưng năm nào luyện các bạn cũng sẽ thấy trong các đề thi thử. Các bạn phải giải chi tiết thì mới nhớ lâu.
Đầu tiên bàn về cách làm, vì hỗn hợp sắt và oxit qúa nhiều nên viết pt là không khả thi. Cách làm của mình là giả sử nó là hỗn hợp Fe và O.
Ta có 56x + 16y = 8.16g = phương trình khối lượng
Vì Y dư HNO3 nên mới tạo ra NO khi tiếp tục phản ứng với Fe nữa nên chắc chắn Fe lên +3 tất, O xuống -2, N từ +5 xuống +2 trong NO.
Vậy 3x = 2y + 1.344 * 3/22.4
Tại sao mình không tính luôn 1.344/22.4 vì máy tính sẽ tính cho bạn, bạn lập hệ là máy tính tự tính kết qủa. x = 0.12, y = 0.09, số mol NO = 0.06
Bây giờ các bạn chú ý đề bài lừa nè. Đây là TỐI ĐA Fe có thể tác dụng được, nên nó sẽ tác dụng với cả HNO3 cho lên +3 nhưng sau đó Fe lại tác dụng để xuống +2.
Vậy cuối cùng là Fe ở mức Fe2+.
0.12 Fe3+ tác dụng được với 0.06Fe để tạo ra Fe2+
5.04 = 0.09 mol Fe nên sẽ còn 0.03 mol tác dụng với HNO3.
0.03mol Fe cho 0.06 mol e để lên +2, nên số mol NO sẽ là 0.02.
Từ đó: NO = 0.06 + 0.02 = 0.08
Fe2+ = 0.09 + 0.12 = 0.21
HNO3 = NO3- + NO = 0.21*2 + 0.08 = 0.5
Vậy C
mình thắc mắc chút :tại sao 0,03 mol fe lại lên fe 2+ mà không phải là 3+