Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi nFe = x (mol) ⇒ nAl = 2nFe = 2x (mol)
mhỗn hợp= 56x + 2x. 27 = 5,5⇒ x = 0,05 (mol)⇒ nFe = 0,05 (mol), nAl = 0,1 (mol)
nAgNO3 = 0,3.1 = 0,3 (mol)
Viết PTHH có xảy ra theo thứ tự:
Al + 3AgNO3 → Al(NO3)3 + 3Ag↓ (1)
Fe + 3AgNO3 → Fe(NO3)2+ 3Ag↓ (2)
Fe(NO3)2 + AgNO3 → Fe(NO3)3 + Ag↓ (3)
nAl = 0,1 (mol); nAgNO3 = 0,3 (mol) ⇒ chỉ xảy ra phản ứng (1). Không xảy ra phản ứng (2) và (3)
⇒m rắn = mAg↓ + mFe dư = 3*0,1*108 + 0,05*56 = 35,2 (g)

Đáp án B.
Các phương trình hóa học có thể xảy ra :
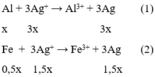
nAgNO3 = 0,3. 1 = 0,3 mol
Gọi số mol Al là x thì số mol Fe là 0,5x
Theo đề bài ta có: 27x + 56. 0,5x = 5,5 (1) suy ra x = 0,1 mol
Theo pt(1) nAgNO3 = 3. nAl = 3. 0,1 = 0,3 mol do đó chỉ xảy ra phản ứng (1).
Chất rắn thu được sau phản ứng là Ag và Fe
Khối lượng chất rắn = mAg + mFe = 0,3. 108 + 0,1. 0,5. 56 = 35,2 (g)

\(\left\{{}\begin{matrix}24n_{Mg}+27n_{Al}=10,5\\\dfrac{n_{Mg}}{n_{Al}}=\dfrac{1}{3}\end{matrix}\right.=>\left\{{}\begin{matrix}n_{Mg}=0,1\\n_{Al}=0,3\end{matrix}\right.\)
\(n_{CuCl_2}=0,25.1=0,25\left(mol\right)\)
PTHH: Mg + CuCl2 --> MgCl2 + Cu
0,1--->0,1----------------->0,1
2Al + 3CuCl2 --> 2AlCl3 + 3Cu
0,1<---0,15----------------->0,15
=> \(\left\{{}\begin{matrix}n_{Al}=0,2\left(mol\right)\\n_{Cu}=0,25\left(mol\right)\end{matrix}\right.\)
=> m = 0,2.27 + 0,25.64 = 21,4 (g)
\(\left\{{}\begin{matrix}24.n_{Mg}+27.n_{Al}=10,5\\\dfrac{n_{Mg}}{n_{Al}}=\dfrac{1}{3}\end{matrix}\right.=>\left\{{}\begin{matrix}n_{Mg}=0,1\\n_{Al}=0,3\end{matrix}\right.\)
\(n_{CuCl_2}=0,25.1=0,25\left(mol\right)\)
PTHH: Mg + CuSO4 --> MgSO4 + Cu
0,1--->0,1-------->0,1------>0,1
2Al + 3CuSO4 --> Al2(SO4)3 + 3Cu
0,1<-0,15--------------------->0,15
=> \(\left\{{}\begin{matrix}n_{Al}=0,3-0,1=0,2\left(mol\right)\\n_{Cu}=0,25\left(mol\right)\end{matrix}\right.=>m=0,2.27+0,25.64=21,4\left(g\right)\)

Đáp án C
Sơ đồ quá trình ta có:
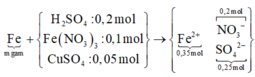
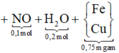
BTKL kim loại ta có:
![]() + 0,75 m
+ 0,75 m
⇔ m = 43,2 gam

Đáp án D
Gọi số mol của Fe và Cu lần lượt là x và y
Xét phản ứng của Fe và Cu với AgNO 3 dư, thu được 35,64 gam kim loại là Ag




Đáp án C
Sơ đồ quá trình ta có:
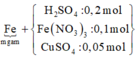
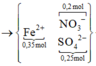
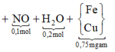
BTKL kim loại ta có: m + 0,1.56 + 0,05.64 = 0,35.56 + 0,75m => m = 43,2 gam

Đáp án C
Ta có: ![]()
Ta có: ![]()
Bảo toàn điện tích:

Do vậy rắn Z chứa 0,038 mol Mg dư.
BTKL:
Do vậy rắn Z chứa 0,038 mol Mg dư.
BTKL: ![]()
![]()

Đáp án D
nAgNO3 = 0,036 mol
nCu(NO3)2 = 0,024 mol
Xét cả quá trình phản ứng, ta thấy chỉ có Mg nhường e và Ag+, Cu2+ nhận e.
Bte: 2nMg pư = nAg+ + 2nCu2+ => nMg pư = (0,036 + 2.0,024):2 = 0,042 mol
=> nMg dư = 0,08 – 0,042 = 0,038 mol
Ta có: mX + mY = m + mAg + mCu + mMg dư => 4,21 + 4,826 = m + 0,036.108 + 0,024.64 + 0,038.24
=> m = 2,7 gam
Chọn B
Gọi số mol Fe là x => số mol Al là 2x
Ta có: 56x + 27.2x = 5,5 => x = 0,05;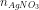 = 0,3.1 = 0,3 (mol)
= 0,3.1 = 0,3 (mol)
Al + 3Ag+ → Al3+ + 3Ag
0,1 0,3 0,3 (mol)
Vậy chất rắn thu được gồm Fe và Ag; m = 0,05.56 + 108.0,3 = 35,2 (gam).
Cho 5,5 gam hỗn hợp bột Al và Fe ( tỉ lệ mol 2:1) vào 330 ml dung dịch AgNO31M. Khuấy kĩ cho oharn ứng xẩy ra hoàn toàn thu được m gam chất rắn. Giá trị của m là
A. 33,95 gam
B. 35,20 gam
C. 39,35 gam
D. 35,39 gam