Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Cho 3,6g một oxit sắt vào dung dịch HCl dư. Sau khi phản ứng xảy ra hoàn toàn thu được một muối sắt clorua. Hãy xác định công thức phân tử của oxit sắt

Gọi công thức hóa học của oxit sắt là F e x O y
PTHH của phản ứng là:
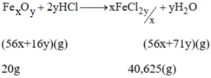
Theo PTHH ta có:
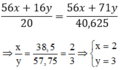
Vậy công thức hóa học của oxit sắt là F e 2 O 3

\(Fe_xO_y+2yHCl\rightarrow xFeCl_{\dfrac{2y}{x}}+yH_2O\)
3,2 6,5
Có:
\(6,5\left(M_{Fe_xO_y}\right)=3,2.\left(x.M_{FeCl_{\dfrac{2y}{x}}}\right)\\ \Leftrightarrow6,5\left(56x+16y\right)=3,2\left(56x+35,5.2.y\right)\\ \Leftrightarrow364x+104y-179,2x-227,2y=0\\ \Leftrightarrow184,8x=123,2y\\ \Rightarrow\dfrac{x}{y}=\dfrac{2}{3}\)
Vậy CTPT của oxit sắt là `Fe_2O_3`
Ủa đề bài có ngộ k z, cho là FeO rồi CTPT oxit gì?

Oxit sắt : FexOy
\(CO_2 + Ca(OH)_2 \to CaCO_3 + H_2O\\ n_{CO_2} = n_{CaCO_3} =\dfrac{22,5}{100} = 0,225(mol)\\ Fe_xO_y + yCO \xrightarrow{t^o} xFe + yCO_2\\ n_{oxit} = \dfrac{n_{CO_2}}{y} = \dfrac{0,225}{y}(mol)\\ \Rightarrow \dfrac{0,225}{y}(56x + 16y) = 12\\ \Rightarrow \dfrac{x}{y} = \dfrac{2}{3}\)
Vậy CTHH của oxit : Fe2O3

Vì sau phản ứng chỉ thu được 1 oxit sắt nên oxit sắt không phải là oxi sắt từ.
Gọi CT oxit là Fe2Oa
Fe2Oa(\(\dfrac{10,8}{112+16a}\))+2aHCl→2FeCla(\(\dfrac{10,8}{56+8a}\))+aH2O
nFe2Oa=\(\dfrac{10,8}{112+16a}\)
⇒\(\dfrac{10,8}{56+8a}.\left(56+35,5a\right)=19,05\)
⇔a=2
Vậy CT của oxit sắt là FeO

X gồm Fe và Cu. Với HCl:
nFe = nH2 = 0,04
=>nCu = (mX – mFe)/64 = 0,02
=> nCuO = nFexOy = 0,02
-> x = nFe/nFexOy = 2
; Oxit là Fe2O3.
Bảo toàn O: \(m_{O\left(oxit\right)}=m_{giảm}=4,8-3,52=1,28\left(g\right)\)
\(n_{O\left(oxit\right)}=\dfrac{1,28}{16}=0,08\left(mol\right)\\ n_{H_2}=\dfrac{0,896}{22,4}=0,04\left(mol\right)\)
PTHH: Fe + 2HCl ---> FeCl2 + H2
0,04 <------------------------ 0,02
\(m_{Cu}=3,52-0,04.56=1,28\left(g\right)\\ n_{O\left(CuO\right)}=n_{Cu}=\dfrac{1,28}{64}=0,02\left(mol\right)\\ n_{O\left(Fe_xO_y\right)}=0,08-0,02=0,06\left(mol\right)\)
CTHH: FexOy
=> x : y = 0,04 : 0,06 = 2 : 3
CTHH Fe2O3

Theo gt ta có: $n_{CO}=0,1(mol)$
Bảo toàn nguyên tố C và theo tỉ khối ta có:
$n_{CO}=0,025(mol);n_{CO_2}=0,075(mol)$
Ta lại có: $n_{O/oxit}=n_{CO_2}=0,075(mol)$
Gọi CTTQ của oxit sắt đó là $Fe_xO_y$
Ta có: $M_{Fe_xO_y}=\frac{160y}{3}$
Do đó công thức của oxit sắt là $Fe_3O_4$

\(Fe_{x.}O_y+2yHCl\rightarrow xFeCl_{\dfrac{2y}{x}}+yH_2O\)
56x+16y........................56x+71y
3,6.....................................6,35
Ta có: 3,6.(56x+71y)=6,35.(56x+16y)
.......=>154x=154y
=>\(\dfrac{x}{y}=\dfrac{1}{1}\)
CT: FeO