Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Dung dịch Y chứa Fe3+ (a); Fe2+ (b), Cl- (0,88) và nH+ dư = 4nNO = 0,88 (mol)
Bảo toàn điện tích: 3a + 2b + 0,08 = 0,88 (1)
nAgCl = 0,88 => nAg = 0,07 (mol)
Bảo toàn electron: b = 0,03.2 + 0,07 (2)
Từ (1) và (2) => a = 0,18 và b = 0,13 (mol)
Quy đổi hỗn hợp thành Fe ( 0,31 mol) ; O ( u mol) và NO3- ( v mol). Trong Z, đặt nN2O = x => nNO2 = 0,2 – x (mol)
=> 0,31.56 + 16u + 62v = 27,04 (3)
Bảo toàn nguyên tố N:
v + 0,04 = 2x + (0,12 –x) (4)
nH+ pư = 0,88 + 0,04 – 0,08 = 0,84
=> 10x + 2( 0,12 –x) + 2u = 0,84 (5)
Từ (3), (4), (5) => u = 0,14 ; v = 0,12 ; x = 0,04
nFe(NO3)2 = v/2 = 0,06 (mol)
Đặt k, 3h, 2h, h lần lượt là số mol Fe, FeO, Fe3O4, Fe2O3
Bảo toàn Fe: => 0,06 + k + 11h = 0,31 (6)
Bảo toàn O : => 14h = u = 0,14 (7)
Từ (6) và (7) => k = 0,14 (mol); h = 0,01 (mol)
Số mol hỗn hợp = 0,06 + k + 6h = 0,26
=> %nFe = 0,14/0,26 = 53,85%
Gần nhất với 54%
Đáp án A

Đáp án C
Phân tích kết tủa:
0,88 mol Cl → 0,88 mol AgCl → 133,84 gam kết tủa còn 0,07 mol Ag nữa.
AgNO3 + dung dịch Y → 0,02 mol NO chứng tỏ trong Y chứa 0,08 mol H+.
Thêm nữa, kết tủa có Ag → chứng tỏ trong Y có Fe2+ → Y không chứa NO 3 - .
Rõ hơn quan sát sơ đồ:
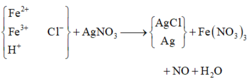
Theo đó, bảo toàn Ag có 0,95 mol AgNO3 → có 0,31 mol Fe(NO3)3.
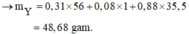
→ Bảo toàn nguyên tố N có số mol Fe(NO3)2 trong X là 0,06 mol.
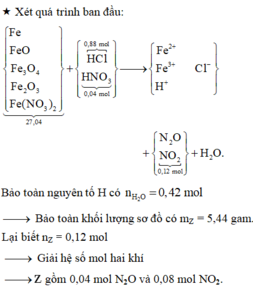
Nhìn 27,04 gam X gồm 0,31 mol Fe + 0,12 mol NO3 + ? mol O → ? = 0,14 mol.
Lại có tỉ lệ FeO : Fe3O4 : Fe2O3 = 3:2:1
→ viết gộp cụm: 3FeO.2Fe3O4.1Fe2O3 = Fe11O14.
→ từ 0,14 mol O suy ra có 0,01 mol Fe11O14.
→ đọc ra có 0,03 mol FeO + 0,02 mol Fe3O4 + 0,01 mol Fe2O3.
→ nFe có trong X ban đầu = 0,31 - 0,11 - 0,06 = 0,14 mol
→ yêu cầu %nFe có trong hỗn hợp X
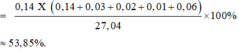

Đáp án B
Phần kết tủa có nAgCl= 0,3 => nAg = 0,009
Bảo toàn electron: nFe2+ = nAg + 3nNO = 0,036
nNO = 0,009 => nH+ dư = 4nNO = 0,036
Đặt a, b, c là số mol Fe, Fe3O4, Fe(NO3)2 trong X
=> mX = 56a + 232b + 180c = 7,488 (1 )
Dung dịch Y còn H+ dư và Fe2+ nên NO3- đã hết.
Vậy Y chứa Fe2+ (0,036), H+ (0,036), Cl- (0,3)
Bảo toàn điện tích => nFe3+ = 0,064
Bảo toàn Fe => a + 3b + c = 0,064 + 0,036 (2)
Bảo toàn H => nH2O = 0,144
Bảo toàn O: 4nFe3O4 + 6nFe(NO3)2 + 3nHNO3 = nZ + nH2O
=> 4b + 6c + 0,024 . 3 = 0,032 + 0,144 (3)
Giải hệ (1)(2)(3):
a = 0,05
b = 0,014
c = 0,008
=> %Fe = 37,4%

Đáp án B
Phương pháp:
Bảo toàn electron
Bảo toàn điện tích
Bảo toàn nguyên tố Fe, O, H
Hướng dẫn giải:
Phần kết tủa có nAgCl= 0,3 => nAg = 0,009
Bảo toàn electron: nFe2+ = nAg + 3nNO = 0,036
nNO = 0,009 => nH+ dư = 4nNO = 0,036
Đặt a, b, c là số mol Fe, Fe3O4, Fe(NO3)2 trong X
=> mX = 56a + 232b + 180c = 7,488 (1 )
Dung dịch Y còn H+ dư và Fe2+ nên NO3- đã hết.
Vậy Y chứa Fe2+ (0,036), H+ (0,036), Cl- (0,3)
Bảo toàn điện tích => nFe3+ = 0,064
Bảo toàn Fe => a + 3b + c = 0,064 + 0,036 (2)
Bảo toàn H => nH2O = 0,144
Bảo toàn O: 4nFe3O4 + 6nFe(NO3)2 + 3nHNO3 = nZ + nH2O
=> 4b + 6c + 0,024 . 3 = 0,032 + 0,144 (3)
Giải hệ (1)(2)(3): a = 0,05 b = 0,014 c = 0,008
=> %Fe = 37,4%

Đáp án B
Ta có sơ đồ phản ứng:
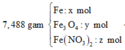
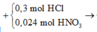

* Y + AgNO3
Bảo toàn nguyên tố Cl:
![]()
![]()
![]()
Fe2+ →Fe3+ + 1e
4H+ + NO−3 + 3e → NO + H2O
0,036 ← 0,027 ← 0,009
Ag+ + 1e → Ag
0,009 ← 0,009
Bảo toàn electron ta có: n F e 2 + = 0,027 + 0,009 = 0,036 mol
Dung dịch Y gồm: Fe2+ : 0,036 mol, H+ : 0,036 mol, Cl− : 0,3 mol, Fe3+
Bảo toàn điện tích ta có:
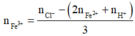
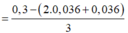
= 0,064 mol
* X + HNO3
n H + p h ả n ứ n g = 0,3 + 0,024 - 0,036 = 0,288 mol
![]()
Bảo toàn nguyên tố oxi ta có: 4b + 6c + 0,024.3 + 0,144 => 2b + 3c = 0,052 (1)
Ta có hệ phương trình:
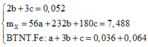
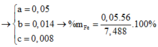
= 37,4 %.

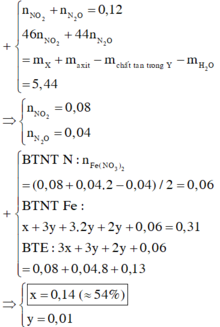



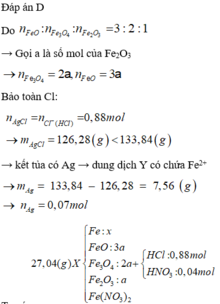
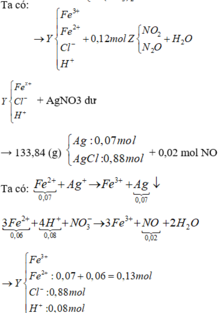

Đáp án C