Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nHCl= 0.225*2=0.45 mol
Gọi x,y,z lần lượt là số mol của CuO, Fe2O3, MgO
CuO + 2HCl -> CuCl2 + H2O
x..............2x
Fe2O3 + 6HCl -> 2FeCl3 + 3H2O
y................6y
MgO + 2HCl -> MgCl2 + H2O
z.............2z
=>80x+160y+40z=12 (1)
2x+6y+2z= 0.45(2)
Cacbon mono oxit không khử được MgO vì nó là oxit của kim loại khá hoạt động :
CuO + CO ---t0----> Cu +CO2
x................................x
Fe2O3 + 3CO ----t0----> 2Fe + 3CO2
y........................................2y
Ta có: 64x+112y+40z=10(3)
giải (1),(2),(3) ta được : x=0.05 ,y=0.025,z= 0.1
=> mCuO = 0.05*80=4g
mFe2O3= 0.025*160=4g
=>mMgO= 12- 4- 4= 4g

1. Gọi x,y lần lượt là số mol của CuO, Fe2O3
Pt: \(CuO+H_2SO_4\rightarrow CuSO_4+H_2O\) (1)
x \(\rightarrow x\)
Pt; \(Fe_2O_3+3H_2SO_4\rightarrow Fe_2\left(SO_4\right)_3+3H_2O\) (2)
y \(\rightarrow y\)
Theo gt: \(\dfrac{n_{CuSO_4}}{n_{Fe_2\left(SO_4\right)_3}}=\dfrac{2}{3}\)
(1)(2) \(\dfrac{n_{CuSO_4}}{n_{Fe_2\left(SO_4\right)_3}}=\dfrac{x}{y}\)
--------------------------- ( múc hai cái lại )
\(\Rightarrow\dfrac{x}{y}=\dfrac{2}{3}\)
\(\Rightarrow x=\dfrac{2y}{3}\)
\(m_{CuO}=\dfrac{2y}{3}.80=\dfrac{160}{3}y\)
\(m_{Fe_2O_3}=160y\)
\(m_{hh}=\dfrac{160}{3}y+160y=\dfrac{640y}{3}\)
\(\%_{CuO}=\dfrac{\dfrac{160}{3}y}{\dfrac{640}{3}y}.100=25\%\)
\(\%_{Fe_2O_3}=\dfrac{160y}{\dfrac{640}{3}y}.100=75\%\)
3. \(n_{H_2SO_4}=0,2.1,5=0,3\left(mol\right)\)
Gọi x,y lần lượt là số mol của Al2O3 ; CaO
Pt: \(Al_2O_3+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2O\) (1)
x \(\rightarrow\) 3x
\(CaO+H_2SO_4\rightarrow CaSO_4+H_2O\) (2)
y \(\rightarrow\) y
(1)(2) \(\Rightarrow\left\{{}\begin{matrix}3x+y=0,3\\102x+56y=11,52\end{matrix}\right.\)\(\Rightarrow\left\{{}\begin{matrix}x=0,08\\y=0,06\end{matrix}\right.\)
a) \(m_{Al_2O_3}=0,08.102=8,16\left(g\right)\)
\(m_{CaO}=0,06.56=3,36\left(g\right)\)
b) Pt: \(Al_2O_3+6HCl\rightarrow2AlCl_3+3H_2O\) (3)
0,08mol \(\rightarrow\) 0,48mol
\(CaO+2HCl\rightarrow CaCl_2+H_2O\) (4)
0,06mol\(\rightarrow\) 0,12mol
(3)(4) \(\Rightarrow\Sigma_{n_{HCl}}=0,48+0,12=0,6\left(mol\right)\)
\(m_{dd_{HCl}}=\dfrac{0,6.36,5}{15}.100=146\left(g\right)\)

Trong 20 gam hỗn hợp A, gọi nMgO = a; nCuO = b; n F e 2 O 3 = c
Các phản ứng hòa tan A vào dung dịch HCl:
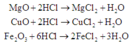
(Đơn giản có thể coi: 2H+ + O2- → H2O để nhẩm nhanh nHCl theo số mol các oxit)
Do đó 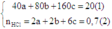
Khi cho H2 đi qua hỗn hợp A gồm MgO, CuO và Fe2O3 thì chỉ có CuO và Fe2O3 bị khử (Mg đứng trước Al trong dãy hoạt động hóa học nên MgO không bị khử). Vì H2 dư nên các oxit này bị khử hoàn toàn về kim loại tương ứng:
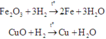
Khi đó H2 dư khử (a + b + c) mol hỗn hợp A, sau phản ứng thu được (b + 3c) mol H2O. Mà theo giả thiết, lấy 0,4 mol hỗn hợp A đốt nóng trong ống sứ không có không khí rồi cho luồng H2 dư đi qua tới phản ứng hoàn toàn thu được 7,2 gam H2O (0,4 mol H2O) nên ta lập tỉ lệ để tìm mối quan hệ:
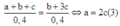
Từ (1), (2), (3) có 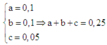
Do đó, 0,4 mol hỗn hợp A có khối lượng là: 0 , 4 0 , 25 . 20 = 32(gam)
![]()
Đáp án C.

\(n_{HCl}=0,3.1=0,3mol\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
0,1 0,3 0,15 ( mol )
\(m_{Al}=0,1.27=2,7g\)
\(\Rightarrow m_{Al}=9,1.2,7=6,4g\)
\(V_{H_2}=0,15.22,4=3,36l\)
nHCl = 0,3 . 1 = 0,3 (mol)
PTHH: 2Al + 6HCl -> 2AlCl3 + 3H2
Mol: 0,1 <--- 0,3 ---> 0,1 ---> 0,15
mAl = 0,1 . 27 = 2,7 (g(
mCu = 9,1 - 2,7 = 6,4 (g)
VH2 = 0,15 . 22,4 = 3,36 (l)
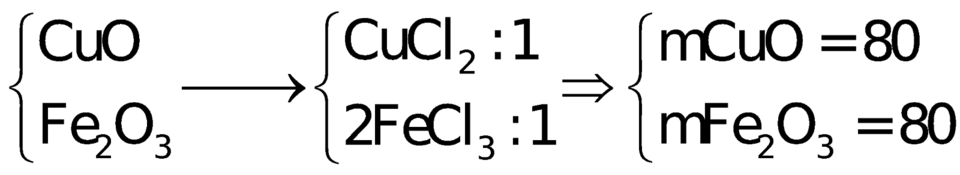
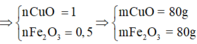
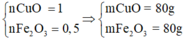

lớp 9, 8nha ko phải lớp 12
lp8