Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Sửa đề: 6,4 gam hh \(\rightarrow\) 6,45 gam hh
a) Đặt \(\left\{{}\begin{matrix}n_{Mg}=a\left(mol\right)\\n_{Al}=b\left(mol\right)\end{matrix}\right.\) \(\Rightarrow24a+27b=6,45\) (1)
Ta có: \(n_{H_2}=\dfrac{7,28}{22,4}=0,325\left(mol\right)\)
Bảo toàn electron: \(2a+3b=0,65\) (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}a=n_{Mg}=0,1\left(mol\right)\\b=n_{Al}=0,15\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}\%m_{Mg}=\dfrac{0,1\cdot24}{6,4}\cdot100\%=37,5\%\\\%m_{Mg}=62,5\%\end{matrix}\right.\)
b) Ta thấy với 6,45 gam hh thì có 0,1 mol Mg và 0,15 mol Al
\(\Rightarrow\) Trong 12,9 gam hh thì chứa 0,2 mol Mg và 0,3 mol Al
Gọi \(n_{SO_2}=x\left(mol\right)\)
Bảo toàn electron: \(2\cdot0,2+3\cdot0,3=2x\) \(\Rightarrow x=n_{SO_2}=0,65\left(mol\right)\)
\(\Rightarrow V_{SO_2}=0,65\cdot22,4=14,56\left(l\right)\)
gọi số mol của Mg là x mol ; Al là y mol => 24x + 27y =6,4
n khí = 7,28/22,4=0,325 mol
bảo toàn e ta có
Mg + H2SO4 --> MgSO4 + H2
x x mol
2Al + 3H2SO4 --> Al2(SO4)3 + 3H2
y 3/2 y mol
=> x + 3/2y=0,325
=> x=11/120 mol ; y=7/45 mol
=> mMg11/120*24=2,2g => %mMg = 2,2*100/6,4=34,375%
=>%mAl=100-34,375=65,625%

Đáp án B
Số mol H2 thu được là: n H 2 = 0 , 3 mol
Đặt số mol các chất trong X là Zn: a mol ; Fe: b mol.
m Zn + m Fe = m X ⇒ 65 a + 56 b = 18 , 6 ( I )
Sơ đồ phản ứng:
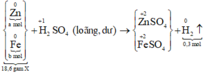
Các quá trình nhường, nhận electron:
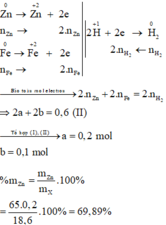

a)
$Cu + 2H_2SO_4 \to CuSO_4 + SO_2 + H_2O$
$2Fe + 6H_2SO_4 \to Fe_2(SO_4)_3 + 3SO_2 + 6H_2O$
b) n Cu =a (mol) ; n Fe = b(mol)
=> 64a + 56b = 12(1)
n SO2 = a + 1,5b = 5,6/22,4 = 0,25(2)
(1)(2) suy ra a = b = 0,1
%m Cu = 0,1.64/12 .100% = 53,33%
%m Fe = 100% -53,33% = 46,67%
c)
n CuSO4 = a = 0,1(mol)
n Fe2(SO4)3 = 0,5a = 0,05(mol)
m muối = 0,1.160 + 0,05.400 = 36(gam)
d) n H2SO4 = 2n SO2 = 0,5(mol)
V H2SO4 = 0,5/2 = 0,25(lít)

Bài 3 :
a) $Mg + H_2SO_4 \to MgSO_4 + H_2$
$n_{Mg} = n_{H_2} = \dfrac{3,36}{22,4} = 0,15(mol)$
$\%m_{Mg} = \dfrac{0,15.24}{13,2}.100\% = 27,27\%$
$\%m_{Cu} = 100\% -27,27\% = 72,73\%$
b) $n_{Cu} = \dfrac{13,2 - 0,15.24}{64}= 0,15(mol)$
$\Rightarrow m_{muối} = 0,15.120 + 0,15.160= 42(gam)$
Bài 4 :
Gọi $n_{Fe} = a(mol) ; n_{Mg} = b(mol)$
$56a + 24b = 18,4(1)$
$Fe + 2HCl \to FeCl_2 + H_2$
$Mg + 2HCl \to MgCl_2 + H_2$
Theo PTHH : $n_{H_2} = a + b = \dfrac{11,2}{22,4} = 0,5(2)$
Từ (1)(2) suy ra a = 0,2 ; b = 0,3
$\%m_{Fe} = \dfrac{0,2.56}{18,4}.100\% = 60,87\%$
$\%m_{Mg} = 100\% -60,87\% = 39,13\%$
b) $n_{HCl} = 2n_{H_2} = 1(mol)$
$V_{dd\ HCl} = \dfrac{1}{0,8}= 1,25(lít)$

a) Gọi \(\left\{{}\begin{matrix}n_{Fe}=a\left(mol\right)\\n_{Zn}=b\left(mol\right)\end{matrix}\right.\) \(\Rightarrow56a+65b=12,1\) (1)
Ta có: \(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
Bảo toàn electron: \(2n_{Fe}+2n_{Zn}=2n_{H_2}\) \(\Rightarrow2a+2b=0,4\) (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}a=0,1\\b=0,1\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}\%m_{Fe}=\dfrac{0,1\cdot56}{12,1}\cdot100\%\approx46,28\%\\\%m_{Zn}=53,72\%\end{matrix}\right.\)
b)
Bảo toàn nguyên tố: \(\left\{{}\begin{matrix}n_{FeSO_4}=n_{Fe}=n_{Zn}=n_{ZnSO_4}=0,1\left(mol\right)\\n_{H_2SO_4\left(p.ứ\right)}=n_{H_2}=0,2\left(mol\right)\Rightarrow\Sigma n_{H_2SO_4}=0,2\cdot110\%=0,22\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{FeSO_4}=0,1\cdot152=15,2\left(g\right)\\m_{ZnSO_4}=0,1\cdot161=16,1\left(g\right)\\m_{H_2}=0,2\cdot2=0,4\left(g\right)\\m_{H_2SO_4\left(dư\right)}=\left(0,22-0,2\right)\cdot98=1,96\left(g\right)\end{matrix}\right.\)
Mặt khác: \(m_{dd}=m_{KL}+m_{ddH_2SO_4}-m_{H_2}=211,7\left(g\right)\)
\(\Rightarrow\left\{{}\begin{matrix}C\%_{FeSO_4}=\dfrac{15,2}{211,7}\cdot100\%\approx7,18\%\\C\%_{ZnSO_4}=\dfrac{16,1}{211,7}\cdot100\%\approx7,61\%\\C\%_{H_2SO_4}=\dfrac{1,96}{22,4}\cdot100\%\approx0,93\%\end{matrix}\right.\)

`2Fe + 6H_2 SO_[4(đ,n)] -> Fe_2(SO_4)_3 + 6H_2 O + 3SO_2 \uparrow`
`0,1` `0,15` `(mol)`
`2Ag + 2H_2 SO_[4(đ,n)] -> Ag_2 SO_4 + 2H_2 O + SO_2 \uparrow`
`0,2` `0,1` `(mol)`
`n_[SO_2]=[5,6]/[22,4]=0,25(mol)`
Gọi `n_[Fe]=x` ; `n_[Ag]=y`
`=>` $\left[\begin{matrix} 56x+108y=27,2\\ \dfrac{3}{2}x+\dfrac{1}{2}y=0,25\end{matrix}\right.$
`<=>` $\left[\begin{matrix} x=0,1\\ y=0,2\end{matrix}\right.$
`a)%m_[Fe]=[0,1.56]/[27,2] .100~~20,59%`
`=>%m_[Ag]~~100-20,59~~79,41%`
`b)n_[SO_2]=0,15+0,1=0,25(mol)`
`n_[NaOH]=0,5.0,8=0,4(mol)`
Ta có:`T=[0,4]/[0,25]=1,6 ->` Tạo muối `Na_2 SO_3` và `NaHSO_3`
`SO_2 + 2NaOH -> Na_2 SO_3 + H_2 O`
`SO_2 + NaOH -> NaHSO_3`
Gọi `n_[Na_2 SO_3]=x ; n_[NaHSO_3]=y`
`=>` $\left[\begin{matrix} x+y=0,25\\ 2x+y=0,4\end{matrix}\right.$
`<=>` $\left[\begin{matrix} x=0,15\\ y=0,1\end{matrix}\right.$
`=>C_[M_[Na_2 SO_3]]=[0,15]/[0,5]=0,3(M)`
`=>C_[M_[NaHSO_3]]=[0,1]/[0,5]=0,2(M)`
Lần sau chú ý dùng dấu \(\left\{{}\begin{matrix}\\\end{matrix}\right.\) ha, dấu \(\left[{}\begin{matrix}\\\end{matrix}\right.\) có ý nghĩa là xảy ra một trong các trường hợp còn dấu \(\left\{{}\begin{matrix}\\\end{matrix}\right.\) có ý nghĩa là đồng thời xảy ra

nH2= 0,35(mol)
a) PTHH: Mg + 2 HCl -> MgCl2 + H2
x_________2x_______x______x(mol)
PTHH: Fe + 2 HCl -> FeCl2 + H2
y________2y________y_____y(mol)
Ta có hpt: \(\left\{{}\begin{matrix}24x+56y=13,2\\x+y=0,35\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,2\\y=0,15\end{matrix}\right.\)
b) m=m(muối khan)= mMgCl2 + mFeCl2= 95.x+127y=95.0,2+127.0,15= 38,05(g)
a)
Gọi
\(n_{Fe} = a(mol) ; n_{Mg} = b(mol)\\ \Rightarrow 56a + 24b = 13,2(1)\)
\(Mg + 2HCl \to MgCl_2 + H_2\\ Fe + 2HCl \to FeCl_2 + H_2\)
Theo PTHH : \(n_{H_2} = a + b = 0,35(mol)\)(2)
Từ (1)(2) suy ra a = 0,15 ;b = 0,2
Vậy :
\(\%m_{Fe} = \dfrac{0,15.56}{13,2}.100\% = 63,64\%\\ \Rightarrow m_{Mg} = 100\% - 63,64\% = 36,36\%\)
b)
Ta có :\(n_{HCl} = 2n_{H_2} = 0,7(mol)\)
Bảo toàn khối lượng :
\(m_{muối} = m_{kim\ loại} + m_{HCl} - m_{H_2} = 13,2 + 0,7.36,5 - 0,35.2=38,05(gam)\)


\(n_{H_2}=\dfrac{0,784}{22,4}=0,035\left(mol\right)\)
Gọi \(\left\{{}\begin{matrix}n_{Fe}=a\left(mol\right)\\n_{Zn}=b\left(mol\right)\end{matrix}\right.\)
PTHH:
Fe + H2SO4 ---> FeSO4 + H2
a------------------------------>a
Zn + H2SO4 ---> ZnSO4 + H2
b---------------------------->b
\(\Rightarrow\left\{{}\begin{matrix}56a+65b=2,14\\a+b=0,035\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,015\left(mol\right)\\b=0,2\left(mol\right)\end{matrix}\right.\)
PTHH:
2Fe + 6H2SO4(đ, n) ---> Fe2(SO4)3 + 3SO2 + 6H2O
0,015--------------------------------------->0,0225
Zn + 2H2SO4(đ, n) ---> ZnSO4 + SO2 + 2H2O
0,02---------------------------------->0,02
=> VSO2 = (0,0225 + 0,02).22,4 = 0,952 (l)