Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Phần O2 sinh ra khi nung đi hết vào kim loại tạo oxit, đó là lý do ta chỉ thu được một khí Z là NO2 (0,4 mol).
Khi nung hỗn hợp T trong không khí thì sản phẩm thu được sẽ gồm các oxit “bão hòa” hóa trị (CuO, Fe2O3).
Số mol electron tối đa mà X có thể cho là: 3nNO =0,54 mol
Như vậy sẽ cần 0,54/2 = 0,27 mol O đưa vào rắn X để thu được 41,6 gam rắn gồm các oxit “bão hòa”.
→mX = mr + mO = 41,6 -0,27.16=37,28 gam
→m =mX = mNO2 = 37,28+46x0,4=55,68 gam
Chọn đáp án A

HNO3 đặc nên sản phẩm khử sẽ là NO2
Gọi \(\left\{{}\begin{matrix}n_{Fe}=a\left(mol\right)\\n_{Cu}=b\left(mol\right)\end{matrix}\right.\)
Ta có: \(n_{NO_2}=\dfrac{2,688}{22,4}=0,12\left(mol\right)\)
Bảo toàn electron: \(3n_{Fe}+2n_{Cu}=n_{NO_2}\) \(\Rightarrow3a+2b=0,12\)
Bảo toàn nguyên tố: \(\left\{{}\begin{matrix}n_{Fe_2O_3}=\dfrac{1}{2}n_{Fe}=\dfrac{1}{2}a\left(mol\right)\\n_{CuO}=n_{Cu}=b\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow160\cdot\dfrac{1}{2}a+80b=4\) (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}a=0,02\\b=0,03\end{matrix}\right.\) \(\Rightarrow m_{hh}=0,02\cdot56+0,03\cdot64=3,04\left(g\right)\)



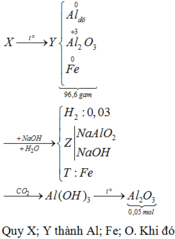




Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O
nFe = \(\dfrac{14}{56}\)= 0,25 mol
nHNO3 = 2.0,4 = 0,8 mol
=> Fe dư sau phản ứng và nFe dư = 0,25 - 0,2 = 0,05 mol
Fe dư tiếp tục phản ứng với Fe(NO3)3
Fe + 2Fe(NO3)3 → 3Fe(NO3)2
0,05 0,2
=> nFe(NO3)2 = 0,05.3 = 0,15 mol
nFe(NO3)3 dư = 0,2 - 0,05.2 = 0,1 mol
Vậy dung dịch X gồm : \(\left\{{}\begin{matrix}Fe\left(NO_3\right)_20,15mol\\Fe\left(NO_3\right)_30,1mol\end{matrix}\right.\)
Cho NaOH dư vào dung dịch X thì thu được kết tủa \(\left\{{}\begin{matrix}Fe\left(OH\right)_20,15mol\\Fe\left(OH\right)_30,1mol\end{matrix}\right.\)
Nung kết tủa trong bìn kính không có oxi
Fe(OH)2 → FeO + H2O
2Fe(OH)3 → Fe2O3 + H2O
=> mCR = mFeO + mFe2O3 = 0,15.72 + 0,05.160= 18,8 gam