

Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



Đáp án C.
Zn + S → ZnS
0,02 0,01 (mol)
Sau phản ứng thu được: ZnS: 0,01 mol và Zn dư 0,01 mol.

1/ \(H_2+S\underrightarrow{t^o}H_2S\)
\(S+Cl_2\underrightarrow{t^o}SCl_2\)
\(S+O_2\underrightarrow{t^o}SO_2\)
\(Hg+S\rightarrow HgS\)
\(Al+S\underrightarrow{t^o}Al_2S_3\)
\(Zn+S\underrightarrow{t^o}ZnS\)
\(Fe+S\underrightarrow{t^o}FeS\)
\(Ag+S\underrightarrow{t^o}Ag_2S\)
\(S+6HNO_{3\left(đ\right)}\rightarrow H_2SO_4+6NO_2+2H_2O\)
2/ \(FeS+2HCl\rightarrow FeCl_2+H_2S\)
\(2H_2S+O_2\rightarrow2H_2O+2S\)
\(S+Na\underrightarrow{t^o}Na_2S\)
\(Na_2S+Zn\left(NO_3\right)_2\rightarrow2NaNO_3+ZnS_{\downarrow}\)
\(ZnS+H_2SO_4\rightarrow ZnSO_4+H_2S\)
Bạn tham khảo nhé!

Đáp án D
Số mol của SO2 thu được là: n SO 2 = 1 , 6 mol
Đặt số mol các chất trong A là FeS2: a mol; ZnS : b mol
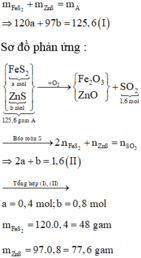

$a\big)$
$Zn+2HCl\to ZnCl_2+H_2$
$ZnS+2HCl\to ZnCl_2+H_2S$
$b\big)$
Đặt $n_{Zn}=x(mol);n_{ZnS}=y(mol)$
$\to 65x+97y=16,2(1)$
Theo PT: $n_{H_2}=x;n_{H_2S}=y$
$\to x+y=\frac{4,48}{22,4}=0,2(2)$
Từ $(1)(2)\to x=y=0,1(mol)$
$Cu(NO_3)_2+H_2S\to CuS\downarrow+2HNO_3$
Theo PT: $n_{CuS}=n_{H_2S}=0,1(mol)$
$\to m=0,1.96=9,6(g)$

\(n_{ZnS}=\frac{29,1}{97}=0,3mol\)
BT (S): \(n_{H_2S}=n_{ZnS}=0,3mol\)
\(\left\{{}\begin{matrix}Zn\\ZnS\end{matrix}\right.\underrightarrow{H_2SO_4l}^{ }_{ }\uparrow\left\{{}\begin{matrix}H_2\\H_2S\end{matrix}\right.\)
Chỉ có H2S bị NaOH hấp thụ thành Na2S
nNaOH=1,75.0,1=0,175 mol
2NaOH + H2S -> Na2S + H2O
Bđ: 0,175 0,3
Pứ: 0,175 -> 0,0875 -> 0,0875
Còn: - 0,2125 0,0875
Dung dịch sau có Na2S và H2S.
\(\left\{{}\begin{matrix}m_{Na_2S}=0,0875.78=6,825g\\m_{H_2S}=0,2125.34=7,225g\end{matrix}\right.\)

Đáp án A
Gọi M là kim loại chung cho Al, Fe và Zn với hóa trị n.
Sơ đồ phản ứng:
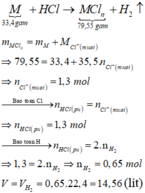

a)
\(n_{Zn}=\dfrac{6,5}{65}=0,1\left(mol\right)\); \(n_S=\dfrac{1,6}{32}=0,05\left(mol\right)\)
PTHH: Zn + S --to--> ZnS
Xét tỉ lệ: \(\dfrac{0,1}{1}>\dfrac{0,05}{1}\) => Zn dư, S hết
Các PTHH:
Zn + S --to--> ZnS
ZnS + 2HCl --> ZnCl2 + H2S
Zn + 2HCl --> ZnCl2 + H2
B chứa H2, H2S
b)
PTHH: Zn + S --to--> ZnS
0,05<-0,05-->0,05
ZnS + 2HCl --> ZnCl2 + H2S
0,05-->0,1----->0,05--->0,05
Zn + 2HCl --> ZnCl2 + H2
0,05-->0,1----->0,05-->0,05
=> nHCl = 0,1 + 0,1 = 0,2 (mol)
\(C\%_{dd.HCl}=\dfrac{0,2.36,5}{100}.100\%=7,3\%\)
c) \(\%V_{H_2S}=\%V_{H_2}=\dfrac{0,05}{0,05+0,05}.100\%=50\%\)
d) \(\overline{M}=\dfrac{0,05.2+0,05.34}{0,05+0,05}=18\left(g/mol\right)\)
=> \(d_{B/H_2}=\dfrac{18}{2}=9\)