Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Ta có: \(n_{NO}+n_{NO_2}+n_{N_2}=\dfrac{22,4}{22,4}=1\left(mol\right)\left(1\right)\)
Mà: mX = 35,8 (g)
\(\Rightarrow30n_{NO}+46n_{NO_2}+28n_{N_2}=35,8\left(2\right)\)
Có: \(n_{Al}=\dfrac{32,4}{27}=1,2\left(mol\right)\)
\(n_{Cu}=\dfrac{22,4}{64}=0,35\left(mol\right)\)
BT e, có: 3nNO + nNO2 + 10nN2 = 3nAl + 2nCu = 4,3 (3)
Từ (1), (2) và (3) \(\Rightarrow\left\{{}\begin{matrix}n_{NO}=0,3\left(mol\right)\\n_{NO_2}=0,4\left(mol\right)\\n_{N_2}=0,3\left(mol\right)\end{matrix}\right.\)
⇒ nHNO3 = 4nNO + 2nNO2 + 12nN2 = 5,6 (mol)

Sửa đề: 6,4 gam hh \(\rightarrow\) 6,45 gam hh
a) Đặt \(\left\{{}\begin{matrix}n_{Mg}=a\left(mol\right)\\n_{Al}=b\left(mol\right)\end{matrix}\right.\) \(\Rightarrow24a+27b=6,45\) (1)
Ta có: \(n_{H_2}=\dfrac{7,28}{22,4}=0,325\left(mol\right)\)
Bảo toàn electron: \(2a+3b=0,65\) (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}a=n_{Mg}=0,1\left(mol\right)\\b=n_{Al}=0,15\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}\%m_{Mg}=\dfrac{0,1\cdot24}{6,4}\cdot100\%=37,5\%\\\%m_{Mg}=62,5\%\end{matrix}\right.\)
b) Ta thấy với 6,45 gam hh thì có 0,1 mol Mg và 0,15 mol Al
\(\Rightarrow\) Trong 12,9 gam hh thì chứa 0,2 mol Mg và 0,3 mol Al
Gọi \(n_{SO_2}=x\left(mol\right)\)
Bảo toàn electron: \(2\cdot0,2+3\cdot0,3=2x\) \(\Rightarrow x=n_{SO_2}=0,65\left(mol\right)\)
\(\Rightarrow V_{SO_2}=0,65\cdot22,4=14,56\left(l\right)\)
gọi số mol của Mg là x mol ; Al là y mol => 24x + 27y =6,4
n khí = 7,28/22,4=0,325 mol
bảo toàn e ta có
Mg + H2SO4 --> MgSO4 + H2
x x mol
2Al + 3H2SO4 --> Al2(SO4)3 + 3H2
y 3/2 y mol
=> x + 3/2y=0,325
=> x=11/120 mol ; y=7/45 mol
=> mMg11/120*24=2,2g => %mMg = 2,2*100/6,4=34,375%
=>%mAl=100-34,375=65,625%

Đáp án D
Số mol H2 thu được là : n H 2 = 11 , 2 22 , 4 = 0 , 5 mol
Gọi M là kim loại chung cho Al và Mg với hóa trị n
Sơ dồ phản ứng :
M ⏟ 10 , 2 gam + H 2 S O 4 ( l o ã n g , d ư ) → M 2 ( S O 4 ) n ⏟ m u ố i + H 2 ↑ ⏟ 0 , 5 m o l
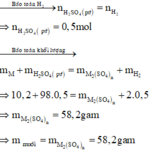

a) PTHH: \(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\) (1)
\(Mg+2HCl\rightarrow MgCl_2+H_2\uparrow\) (2)
b) Dựa vào đề, ta thấy chắc chắn HCl dư
Ta có: \(\Sigma n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
Gọi số mol của Fe là \(a\) \(\Rightarrow n_{H_2\left(1\right)}=a\)
Gọi số mol của Mg là \(b\) \(\Rightarrow n_{H_2\left(2\right)}=b\)
Ta lập được hệ phương trình:
\(\left\{{}\begin{matrix}56a+24b=8\\a+b=0,2\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}a=0,1\\b=0,1\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}m_{Fe}=56\cdot0,1=5,6\left(g\right)\\m_{Mg}=24\cdot0,1=2,4\left(g\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Fe}=\dfrac{5,6}{8}\cdot100\%=70\%\\\%m_{Mg}=30\%\end{matrix}\right.\)
c) Theo các PTHH: \(n_{FeCl_2}=n_{MgCl_2}=n_{Fe}=n_{Mg}=0,1mol\)
\(\Rightarrow\left\{{}\begin{matrix}m_{FeCl_2}=0,1\cdot127=12,7\left(g\right)\\m_{MgCl_2}=0,1\cdot95=9,5\left(g\right)\end{matrix}\right.\) \(\Rightarrow m_{muối}=22,2\left(g\right)\)
d) Ta có: \(\Sigma n_{HCl}=\dfrac{500\cdot16\%}{36,5}=\dfrac{160}{73}\left(mol\right)\)
\(\Rightarrow n_{HCl\left(dư\right)}=\dfrac{654}{365}\left(mol\right)\) \(\Rightarrow m_{HCl\left(dư\right)}=\dfrac{654}{365}\cdot36,5=65,4\left(g\right)\)
Mặt khác: \(m_{dd}=m_{hh}+m_{ddHCl}-m_{H_2}=507,6\left(g\right)\)
\(\Rightarrow\left\{{}\begin{matrix}C\%_{FeCl_2}=\dfrac{12,7}{507,6}\cdot100\%\approx2,5\%\\C\%_{MgCl_2}=\dfrac{9,5}{507,6}\cdot100\%\approx1,87\%\\C\%_{HCl\left(dư\right)}=\dfrac{65,4}{507,6}\cdot100\%\approx12,88\%\end{matrix}\right.\)

- Gọi số mol Al và Fe trong hốn hợp lần lượt là a, b mol
PTKL : 27a + 56b = 22
BTe : 3a + 3b = 1,8
=> a = 0,4 và b = 0,2 .
=> mAl = 10,8g và mFe = 11,2 g
b, Sau phản ứng thu được muối Al2(SO4)3 và Fe2(SO4)3 .
=> mM = 108,4g
\(n_{Al}=a\left(mol\right),n_{Fe}=b\left(mol\right)\)
\(\Rightarrow27a+56b=22\left(1\right)\)
\(n_{SO_2}=\dfrac{20.16}{22.4}=0.9\left(mol\right)\)
\(2Fe+6H_2SO_{4\left(đ\right)}\rightarrow Fe_2\left(SO_4\right)_3+3SO_2+6H_2O\)
\(2Al+6H_2SO_{4\left(đ\right)}\rightarrow Al_2\left(SO_4\right)_3+3SO_2+6H_2O\)
\(n_{SO_2}=1.5a+1.5b=0.9\left(mol\right)\left(2\right)\)
\(\left(1\right),\left(2\right):a=0.4,b=0.2\)
\(m_{Al}=0.4\cdot27=10.8\left(g\right)\)
\(m_{Fe}=11.2\left(g\right)\)
\(m_{Muối}=0.2\cdot342+0.1\cdot400=108.4\left(g\right)\)

Quy đổi hỗn hợp kim loại thành R, có soh là +n
\(n_R=\dfrac{17,1}{M_R}\left(mol\right)\)
R0 - ne --> R+n
\(\dfrac{17,1}{M_R}\)->\(\dfrac{17,1n}{M_R}\)
S+6 + 2e --> S+4
1<---0,5
Bảo toàn e: \(\dfrac{17,1n}{M_R}=1\Rightarrow M_R=17,1n\)
Muối thu được có CTHH là R2(SO4)n
\(n_{R_2\left(SO_4\right)_n}=\dfrac{17,1}{2.M_R}\left(mol\right)\)
=> \(m_{R_2\left(SO_4\right)_n}=\dfrac{17,1}{2.M_R}\left(2.M_R+96n\right)=17,1+\dfrac{820,8n}{M_R}=65,1\left(g\right)\)
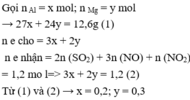

mmuối = mkimloại + m(SO4)2- + mNO3-
= 12,9 + nSO2*96 + (3nNO + nNO2)*62 = 47,3 gam