
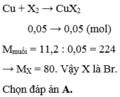
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

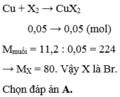

Theo đề, ta có: \(n_{X_2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
PTTH: \(X_2+Cu\rightarrow CuX_2\)
Số mol: 0,05 ----------> 0,05
Theo phương trình, có: \(n_{CuX_2}=n_{Cu}=0,05\left(mol\right)\)
Hay: \(\dfrac{11,2}{64+X.2}=0,05\Leftrightarrow X=80\)
Vậy X là Brom.
Chon (B)

Bảo toàn khối lượng ta có: $m_{R}=2,4(g)$$R+X_2\rightarrow RX_2$
Ta có: $\frac{2,4}{R}=\frac{4,26}{2X}$
Lập bảng biện luận thông qua halogen tìm được X và R lần lượt là Cl và Ca

\(n_{X_2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
PTHH: \(Cu+X_2->CuX_2\)
Theo PT ta có: \(n_{CuX_2}=n_{X_2}=0,05\left(mol\right)\)
=> \(M_{CuX_2}=\dfrac{11,2}{0,05}=224\left(g/mol\right)\)
=> Ta có: \(64+2.X=224\)
\(\Leftrightarrow2X=160\Leftrightarrow X=80\left(Br\right)\)
Vậy nguyên tố halogen đó là Brom (Br)
X2 + Cu → CuX2
\(n_{X_2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
Theo PT: \(n_{CuX_2}=n_{X_2}=0,05\left(mol\right)\)
\(\Rightarrow M_{CuX_2}=\dfrac{11,2}{0,05}=224\left(g\right)\)
\(\Leftrightarrow64+2M_X=224\)
\(\Leftrightarrow2M_X=160\)
\(\Leftrightarrow M_X=80\left(g\right)\)
Vậy X là nguyên tố Brom

Gọi halogen đó là X , CTTQ: CuX2
\(PTHH:Cu+X_2\underrightarrow{^{to}}CuX_2\)
Áp dụng ĐLTL ta có:
\(\Leftrightarrow\frac{22,4}{5,6}=\frac{64+2X}{33,75}\)
\(\Rightarrow x=35,5\left(Clo\right)\)
Vậy halogen là Clo ( Clo )

Câu 1:
Gọi đơn chất halogen là X2
\(Cu+X_2\underrightarrow{^{to}}CuX_2\)
Ta có:
\(n_X=\frac{5,6}{22,4}=0,25\left(mol\right)=n_{CuX2}\)
\(\Rightarrow M_{CuX2}=64+2X=\frac{33,75}{0,25}=135\)
\(\Rightarrow X=35,5\left(Clo\right)\)
Halogen là Cl2 - Clo
Câu 2:
\(PTHH:Fe+2HCl\rightarrow FeCl_2+H_2\)
_______0,15__0,3___0,15___0,15__
\(n_{Fe}=\frac{8,4}{56}=0,15\left(mol\right)\)
a,\(V_{H2}=0,15.22,4=3,36\left(l\right)\)
b, \(CM_{HCl}=\frac{0,3}{0,2}=1,5M\)