
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

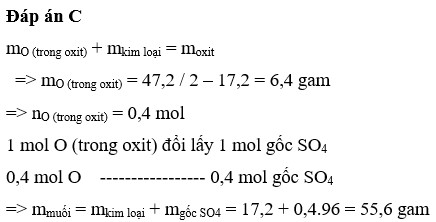

Đáp án C
Vì khối lượng hỗn hợp kim loại ở hai phần bằng nhau và hóa trị của các kim loại trong hỗn hợp là duy nhất nên tổng số mol electron trao đổi ở hai phần là như nhau.
Áp dụng định luật bảo toàn mol electron ta có:
![]()

Đáp án C
P1 : Chỉ có Cu phản ứng được với HNO3 đặc nguội
Bảo toàn e : 2nCu = nNO2 = 0,03 mol
P2 : Chỉ có Fe phản ứng với H2SO4 loãng dư
=> nFe = nH2 = 0,02 mol
=> m = 2. (0,015.64 + 0,02.56) = 4,16g

Phần 1: tác dụng với HNO3 đặc, nguội ⇒ Fe không phản ứng, sản phẩm khử của N + 5 là NO2 (do dùng HNO3 đặc).
⇒ Bảo toàn electron có: 2nCu = n NO 2 = 0,03 mol
⇒ nCu = 0,015 mol.
Phần 2: tác dụng với H2SO4 loãng ⇒ Cu không phản ứng, chỉ có Fe phản ứng:
Fe + H2SO4 → FeSO4 + H2↑
⇒ nFe = n H 2 = 0,02 mol.
Theo đó, m = 2 × (0,015 × 64 + 0,02 × 56) = 4,16 gam
Đáp án C

Giải thích:
Phản ứng xảy ra hoàn toàn, chất rắn sau phản ứng + NaOH thu được khí H2 => chứng tỏ có Al dư sau phản ứng => phản ứng nhiệt nhôm oxit sắt hết. Chất rắn Y gồm có Al2O3, Fe và Al dư
Phần 2: nFe = 16,8 : 56 = 0,3 (mol) ;
Bảo toàn e => 3nAl dư = 2 nH2 => nAl = 2/3. nH2 = a (mol)
Phần 1: Nếu không tạo muối NH4NO3 thì ne ( Fe, Al dư) nhường = ne (NO nhận)
=> 0,3. 3 + 3a = 3a => vô lí
Vậy phải tạo muối NH4NO3
=> nNH4NO3 = ( 3nFe + 3nAl – 3nNO)/8 = ( 0,3. 3+ 3a – 3a) /8 = 0,1125 (mol)
mmuối = mFe(NO3)3 + mAl(no3)3 + mNH4NO3
=> mAl(NO3)3 = 233,7 – 0,3. 242 – 0,1125.80 = 152, 1(g)
nAl(NO3)3 ≈ 0,714 (mol)
Rắn Y phản ứng vừa đủ với dd NaOH
Al2O3 + 2NaOH → 2NaAlO2 + H2O
Al + NaOH → NaAlO2 + 3/2H2
=> nNaOH = nNaAlO2- = nAl(NO3)3 = 0,714 (mol) ( Bảo toàn nguyên tố Al)
=> VNaOH = 0,714: 2 = 0,357 (lít) = 357 (ml)
Gần nhất với 352 ml
Đáp án D

Đáp án A
Khối lượng hỗn hợp kim loại ở mỗi phần là 7,4 gam.
Phần 1: Khối lượng muối thu được lớn hơn khối lượng kim loại ban đầu là do các cation kim loại kết hợp với các gốc S O 4 2 - tạo thành muối.
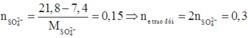
Số mol electron trao đổi ở hai phần bằng nhau.
Do đó ở phần 2: nAg = ne trao đổi = 0,3
=> mAg = 32,4 (gam)
Vậy m = 32,4 – 7,4 = 25 (gam)