Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

FeClx + xAgNO3 ---> xAgCl + Fe(NO3)x
1/(56+35,5x) 2,65/143,5
---> 1/(56+35,5x) = 2,65/143,5x ---> x = 3 ---> FeCl3.

Cho 3,6g một oxit sắt vào dung dịch HCl dư. Sau khi phản ứng xảy ra hoàn toàn thu được một muối sắt clorua. Hãy xác định công thức phân tử của oxit sắt

\(n_{CO_2}=n_{CaCO_3}=\dfrac{10}{100}=0.1\left(mol\right)\)
\(CO_2+Ca\left(OH\right)_2\rightarrow CaCO_3+H_2O\)
\(Fe_xO_y+yCO\underrightarrow{t^0}xFe+yCO_2\)
\(\dfrac{0.1}{x}...............0.1\)
\(M_{Fe_xO_y}=\dfrac{7.2}{\dfrac{0.1}{x}}=72x\)
\(\Leftrightarrow56x+16y=72x\)
\(\Leftrightarrow16x=16y\)
\(\Leftrightarrow\dfrac{x}{y}=\dfrac{1}{1}\)
\(CT:FeO\)
a) CTHH oxit sắt : Fe2On
\(Fe_2O_n + nCO \xrightarrow{t^o} 2Fe + nCO_2\\ CO_2 + Ca(OH)_2 \to CaCO_3 + H_2O\)
b)
Theo PTHH : \(n_{CO_2} = n_{CaCO_3} = \dfrac{10}{100} = 0,1(mol)\\ n_{oxit\ sắt} = \dfrac{n_{CO_2}}{n} = \dfrac{0,1}{n}mol\\ \Rightarrow \dfrac{0,1}{n}(56.2+16n)=7,2\\ \Rightarrow n = 2\)
Vậy CTHH cần tìm : FeO

Gọi công thức hóa học của oxit sắt là F e x O y
PTHH của phản ứng là:
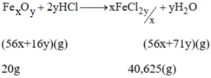
Theo PTHH ta có:
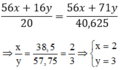
Vậy công thức hóa học của oxit sắt là F e 2 O 3



Gọi hóa trị của sắt clorua là n
Ta có : \(FeCl_n+nAgNO_3\rightarrow Fe\left(NO_3\right)_n+nAgCl\)
Ta có: \(n_{AgCl}=\dfrac{2,65}{143,5}=\dfrac{53}{2870}\left(mol\right)\)
Ta có: \(n_{FeCl_n}=\dfrac{1}{n}n_{AgCl}=\dfrac{53}{2870n}\left(mol\right)\)
=> \(\dfrac{1}{56+35,5n}=\dfrac{53}{2870n}\)
=> n=3
Vậy CT muối: FeCl3
s tính n ra 3 dc v