Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

ClO - và ClO 3 - có cấu tạo tương ứng như sau :
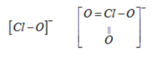
Liên kết ClO - trong ClO 3 - ngắn hơn trong ClO - nên độ bền ClO 3 - > ClO - Do đó tính oxi hoá ClO 3 - < ClO -
Trong dung dịch nước, ion ClO 3 - chỉ oxi hoá trong môi trường axit mạnh, còn ion ClO - oxi hoá trong bất kì môi trường nào.
NaClO + 2KI + H 2 O → NaCl + I 2 + 2KOH
NaCl O 3 + 6KI + 3 H 2 SO 4 → NaCl + 3 I 2 + 3 K 2 SO 4 + 3 H 2 O

a) Khí H2S và axit sunfuric đặc tham gia các phản ứng oxi hóa – khử thì khí H2S chỉ thể hiện tính khử và H2SO4 đặc chỉ thể hiện tính oxi hóa. Vì trong H2S số oxi hóa của S chỉ có thể tăng, trong H2SO4 số oxi hóa S chỉ có thể giảm.
Vì trong H2S số oxi hóa của S là -2 (là số oxi hóa thấp nhất của S) nên chỉ có thể tăng (chỉ thể hiện tính khử), trong H2SO4 số oxi hóa của S là +6 (là số oxi hóa cao nhất của S) nên chỉ có thể giảm (chỉ thể hiện tính oxi hóa).
b) Phương trình phản ứng hóa học:
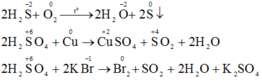

1. a. dd KI xuất hiện màu đỏ tím, sau đó dần trở lại không màu
Cl2 + 2KI \(\rightarrow\) 2KCl + I2 và 5Cl2 + I2 + 6H2O \(\rightarrow\) 2HIO3 + 10HCl
b. Quá trình chuyển X2 \(\rightarrow\) 2X- phụ thuộc vào 2 yếu tố: năng lượng phân li phân tử thành nguyên tử (tức năng lượng liên kết) và ái lực e để biến nguyên tử X thành ion X-
Mặc dù ái lực của flo bé hơn clo, nhưng năng lượng liên kết của flo lại thấp hơn của clo nên flo dễ phân li thành nguyên tử hơn, vì vậy tính oxi hóa của flo mạnh hơn clo
(Năng lượng liên kết của flo thấp hơn clo vì: Trong phân tử F chỉ có các AO p, không có AO trống \(\rightarrow\) phân tử F2 chỉ có liên kết \(\sigma\). Trong nguyên tử Cl, ngoài các AO p còn có AO d trống \(\rightarrow\) phân tử Cl2 ngoài sự xen phủ các AO p để tạo liên kết \(\sigma\), thì mây e còn đặt vào AO d trống, do đó tạo một phần liên kết pi).
2. Dựa vào thể tích và khối lượng hỗn hợp khí, lập hệ pt dễ dàng tính được số mol SO2 = 0,06 và NO2 = 0,02 \(\rightarrow\) số mol e nhận = 0,06.2 + 0,02 = 0,14
Nếu tất cả kim loại đều tan thì ne nhường = 0,03.3 + 0,02.2 + 0,02.2 = 0,17 > 0,14. Như vậy có kim loại còn dư, đó là Cu (vì Cu có tính khử yếu nhất), tính được số mol Cu dư = \(\frac{0,17-0,14}{2}\) = 0,015
Ta có : NO3- + 2H+ +1e \(\rightarrow\) NO2 + H2O
0,02 0,04
SO42- +4H+ +2e \(\rightarrow\) SO2 +2H2O
0,06 0,24
nNO3 -(muối) = nNO3- (ax) – nNO2 = nH+ - nNO2 = 0,04 – 0,02 = 0,02
Tương tự tính được nSO42- = 0,06 mol. Khối lượng muối = mkim loại + mgốc axit
\(\rightarrow\) m = 0,03.27 + 0.02.65 + 0,005.64 + 0,02.62 + 0,06.96 = 9,43 (gam)

a)H2S chỉ thể hiện tính khử vì số oxi hóa của S ở mức thấp nhất :-2 .(Không thể giảm nên chỉ có tình khử)
H2SO4 chỉ thể hiện tính oxi hóa vì số oxi hóa của S ở mức cao nhất :6 . (Không thể tăng nên chỉ có tính oxi hóa)
b)H2S + Pb(NO3)2-->PbS + 2HNO3
H2SO4+ FeS -->H2S + FeSO4

a)\(NaClO + CO_2 + H_2O \to NaHCO_3 + HClO\)
b)\(CaOCl_2 + 2HCl \to CaCl_2 + Cl_2 + H_2O\)
c) \(2KClO_3 \xrightarrow{t^o} 2KCl + 3O_2\)
d)\(KCl^{+5}O_3 + 6HCl^{-1} \to KCl^{-1} + 3Cl^0_2 + 3H_2O\)
a) HClO < H2CO3
\(NaClO+CO_2+H_2O\rightarrow NaHCO_3+HClO\)
b) CaOCl2 có tính OXH
\(CaOCl_2+2HCl\rightarrow CaCl_2+Cl_2+H_2O\)
c) KClO3 kém bền với nhiệt
\(2KClO_3\underrightarrow{t^0}2KCl+3O_2\)
d) KClO3 có tính oxi hóa mạnh
\(KClO_3+6HCl\rightarrow KCl+3Cl_2+3H_2O\)

\(1)Mg + Cl_2 \xrightarrow{t^o} MgCl_2\\ 2)Cl_2 + 2NaOH \to NaCl + NaClO + H_2O\\ 3)Cl_2 + 2NaBr \to 2NaCl + Br_2\\ 4)Cl_2 + 2NaI \to 2NaCl + I_2\\ 5)Br_2 + 2NaI \to 2NaBr + I_2\\ 6)Fe + 2HCl \to FeCl_2 + H_2\\ 7)MnO_2 + 4HCl \to MnCl_2 + Cl_2 + 2H_2O\\ 8)Mg + 2HCl \to MgCl_2 + H_2\\ 9)4HF + SiO_2 \to SiF_4 + 2H_2O\)

Câu 1:
- Axit HFO2 không tồn tại vì Flo không có số oxi hóa -3
- HBrO2 và HIO2 kém bền vì bán kính nguyên tử của Brom và Iot quá lớn nên khó hút các nguyên tử Oxi nên dễ bị phân hủy
Câu 2:
Sắp xếp tính axit: HClO3 > HBrO3 > HIO3 vì nguyên tử halogen giảm dần độ âm điện nên ít ảnh hưởng đến cặp e của liên kết O-H. Liên kết O-H ít phân cực hơn nên tính axit giảm dần.
Sắp xếp độ bền: HClO3 < HBrO3 < HIO3 vì axit càng bền thì càng yếu.
Câu 3:
Ion ClO- có tính oxi hoá mạnh hơn ClO3- vì O trong ClO- dễ bị tách ra khỏi ion hơn.
\(ClO^-\rightarrow Cl^-+O^{\text{∙}}\)
bạn giải thích cụ thể hơn một chút được không ?