Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a: \(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
0,1 0,2 0,1 0,1
b: \(V_{H_2}=0.1\cdot22.4=2.24\left(lít\right)\)
c: \(m_{FeCl_2}=0.1\left(56+35.5\cdot2\right)=12.7\left(g\right)\)

Câu 15 :
\(n_{Al}=\dfrac{10,8}{27}=0,4\left(mol\right)\)
Pt : \(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
0,4----->1,2------->0,4------>0,6
\(m_{HCl}=1,2.36,5=43,8\left(g\right)\)
\(\Rightarrow m_{ddHCl}=\dfrac{43.8.100\%}{25\%}=175,2\left(g\right)\)
\(m_{ddspu}=10,8+175,2-0,6.2=184,8\left(g\right)\)
\(C\%_{AlCl3}=\dfrac{0,4.133,5}{184,8}.100\%=28,9\%\)

a)
$n_{Al} = 0,3(mol)$
$2Al + 3H_2SO_4 \to Al_2(SO_4)_3 + 3H_2$
Theo PTHH :
$n_{H_2SO_4} = \dfrac{3}{2}n_{Al} = 0,45(mol)$
$m_{dd\ H_2SO_4} = \dfrac{0,45.98}{12,25\%} = 360(gam)$
b)
$n_{H_2} = n_{H_2SO_4} = 0,45(mol)$
$V_{H_2} = 0,45.22,4 = 10,08(lít)$
c)
$n_{Al_2(SO_4)_3} = 0,15(mol)$
$m_{dd\ sau\ pư} = 8,1 + 360 - 0,45.2 = 367,2(gam)$
$C\%_{Al_2(SO_4)_3} = \dfrac{0,15.342}{367,2}.100\% = 14\%$

1: \(n_{Zn}=\dfrac{3.25}{65}=0.05\left(mol\right)\)
a: \(Zn+2HCl\rightarrow ZnCl_2+H_2\uparrow\)
0,05 0,1 0,05 0,05
\(m_{dd\left(HCl\right)}=0.1\cdot36.5=3.65\left(g\right)\)
b: \(V_{H_2}=0.05\cdot22.4=1.12\left(lít\right)\)
2)
H3PO4 (axit yếu) : axit photphoric
Zn3(PO4)2 (muối) : kẽm photphat
Fe2(SO4)3 (muối) : sắt (III) sunfat
SO2 (oxit axit) : lưu huỳnh đioxit
SO3 (oxit axit) : lưu huỳnh trioxit
P2O5 (oxit axit) : đi photpho pentaoxit
HCl(axit mạnh) : axit clohidric
Ca(HCO3)2 (muối axit) : canxi hidrocacbonat
Ca(H2PO4)2 (muối aixt) : canxi đihidrophotphat
Fe2O3 (oxit bazơ) : sắt (III) oxit
Cu(OH)2 (bazơ) : đống(II) hidroxit
NaH2PO4 (muối axit) : natri đihidrophotphat
Chúc bạn học tốt

\(n_{CuO}=n_{Cu}=\dfrac{4}{80}=0,05mol\\ n_{H_2}=0,4mol\\ n_{Al}=a;n_{Zn}=b\\ 27a+65b=15,1-0,05\cdot64\\ BTe^-:3a+2b=2\cdot0,4\\ a=0,2;b=0,1\\ m_{ddHCl}=\dfrac{\left(0,6+0,2\right)\cdot36,5}{0,2}=146g\)

a)
Gọi $n_{Fe} = a(mol) ; n_{Al} =b (mol) \Rightarrow 56a + 27b = 11(1)$
$Fe + 2HCl \to FeCl_2 + H_2$
$2Al + 6HCl \to 2AlCl_3 + 3H_2$
Theo PTHH : $n_{H_2} = a + 1,5b = \dfrac{8,96}{22,4} = 0,4(2)$
Từ (1)(2) suy ra : a = 0,1 ; b = 0,2
$\%m_{Fe} = \dfrac{0,1.56}{11}.100\% = 50,9\%$
$\%m_{Al} = 100\% - 50,9\% = 49,1\%$
b) $n_{HCl} = 2n_{H_2} = 0,8(mol)$
$\Rightarrow C_{M_{HCl}} = \dfrac{0,8}{0,4} = 2M$
c)
$C_{M_{FeCl_2}} = \dfrac{0,1}{0,4} = 0,25M$
$C_{M_{AlCl_3}} =\dfrac{0,2}{0,4} = 0,5M$

*Sửa đề: "13,44 lít H2" và "24,9 gam hh 2 kim loại"
PTHH: \(2Al+6HCl\rightarrow2AlCl_3+3H_2\uparrow\)
a_____3a_____________\(\dfrac{3}{2}\)a (mol)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\uparrow\)
b_____2b_____________b (mol)
Ta lập HPT: \(\left\{{}\begin{matrix}27a+65b=24,9\\\dfrac{3}{2}a+b=\dfrac{13,44}{22,4}=0,6\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}a=0,2\\b=0,3\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}n_{Al}=0,2\left(mol\right)\\n_{Zn}=0,3\left(mol\right)\\n_{HCl}=1,2\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}m_{Al}=0,2\cdot27=5,4\left(g\right)\\m_{Zn}=19,5\left(g\right)\\m_{ddHCl}=\dfrac{1,2\cdot36,5}{7,3\%}=600\left(g\right)\end{matrix}\right.\)

Phương trình hóa học của phản ứng:
M + n/2HCl → M Cl n
M + mHCl → M Cl m + m/2 H 2
Theo đề bài, ta có:
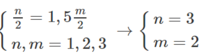
và M + 106,5 = 1,2886 (M+71)
Giải ra, ta có M = 52 (Cr)
Bài 4:
- Chất có pư với Al trong điều kiện thích hợp: Cl2, HCl, CuCl2, ZnCl2, S.
PT: \(2Al+3Cl_2\underrightarrow{t^o}2AlCl_3\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(2Al+3CuCl_2\rightarrow2AlCl_3+3Cu\)
\(2Al+3ZnCl_2\rightarrow2AlCl_3+3Zn\)
\(2Al+3S\underrightarrow{t^o}Al_2S_3\)
- Chất có pư với Fe trong điều kiện thích hợp: Cl2, HCl, CuCl2, S.
PT: \(2Fe+3Cl_2\underrightarrow{t^o}2FeCl_3\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(Fe+CuCl_2\rightarrow FeCl_2+Cu\)
\(Fe+S\underrightarrow{t^o}FeS\)
Bài 5:
Ta có: \(n_{Al}=\dfrac{8,1}{27}=0,3\left(mol\right)\)
PT: \(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
a, \(n_{H_2}=\dfrac{3}{2}n_{Al}=0,45\left(mol\right)\Rightarrow V_{H_2}=0,45.24,79=11,1555\left(l\right)\)
b, \(n_{HCl}=3n_{Al}=0,9\left(mol\right)\)
\(\Rightarrow m_{ddHCl}=\dfrac{0,9.36,5}{12\%}=273,75\left(g\right)\)
c, \(n_{AlCl_3}=n_{Al}=0,3\left(mol\right)\)
\(\Rightarrow m_{AlCl_3}=0,3.133,5=40,05\left(g\right)\)