Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Quy đổi 2 kim loại kiềm Na và K là 1 kim loại trung bình . Khi đó:
2
M
¯
+
2
H
2
O
→
2
M
¯
O
H
H
2
1
6
M
¯
O
H
+
F
e
2
S
O
4
3
→
3
M
¯
2
S
O
4
+
2
F
e
O
H
3
(
2
)
Theo bài ta có: n H 2 = 3,36 22,4 = 0,15 m o l
⇒ n M ¯ O H = 2. n H 2 = 2.0,15 = 0,3 m o l ⇒ n F e ( O H ) 3 = 1 3 n M ¯ O H = 1 3 .0,3 = 0,1 m o l
⇒ m ↓ = m F e ( O H ) 3 = 0,1.107 = 10,7 g a m
⇒ Chọn C.

C → + O 2 A C O C O 2 → + F e O , t 0 B : C O 2 → + C a ( O H ) 2 K : C a C O 3 D : C a H C O 3 2 C F e F e O → + H C l H 2 E : F e C l 2 → + N a O H F : : F e O H 2 → t 0 , k k G : F e 2 O 3
⇒ Chọn A.

- Phần 1 tác dụng với Br2: nBr2 = 16:160 = 0,1 mol
C2H2 + 2Br2 → C2H2Br4
0,05 ← 0,1 (mol)
- Đặt số mol khí mỗi phần như sau:
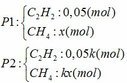
+ Số mol hỗn hợp khí X là: nX = 11,2:22,4 = 0,5 mol
Ta có: n khí P1 + n khí P2 = nX => 0,05 + x + 0,05k + kx = 0,5 <=> (x + 0,05)k = 0,45 - x
=> 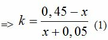
+ Đốt cháy phần 2:
C2H2 + 2,5O2 → t ∘ 2CO2 + H2O
0,05k → 0,1k→ 0,05k (mol)
CH4 + 2O2 → t ∘ CO2 + 2H2O
kx → kx → 2kx (mol)
Sản phẩm cháy gồm
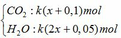
dẫn qua dung dịch Ba(OH)2 dư:
CO2 + Ba(OH)2 → BaCO3↓ + H2O
k(x+0,1) → k(x+0,1) (mol)
Khối lượng dung dịch giảm: m dd giảm = mBaCO3 – mCO2 – mH2O
=> 197k(x+0,1) – 44k(x+0,1) – 18k(2x+0,05) = 69,525
=> 153k(x+0,1) – 18k(2x+0,05) = 69,525
=> k(117x+14,4) = 69,525
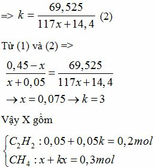
CaC2 + 2H2O → Ca(OH)2 + C2H2
0,2 ← 0,2 (mol)
Al4C3 + 12H2O → 4Al(OH)3 + 3CH4
0,1 ← 0,1 (mol)
Giá trị của m là: m = mCaC2 + mAl4C3 = 0,2.64 + 0,1.144 = 27,2 gam
Phần trăm thể tích các khí trong X là:

tác dụng với AgNO3 trong NH3 dư:
C2H2 + 2AgNO3 + 2NH3 → Ag2C2↓ + 2NH4NO3
0,15 → 0,15 (mol)
Khối lượng kết tủa thu được là: mAg2C2 = 0,15.240 = 36 gam

\(a,\) Đặt \(n_{Al}=x(mol);n_{Fe}=y(mol)\)
\(\Rightarrow 27x+56y=11(1)\\ 2Al+3H_2SO_4\to Al_2(SO_4)_3+3H_2\\ Fe+H_2SO_4\to FeSO_4+H_2\\ Al_2(SO_4)_3+6NaOH\to 2Al(OH)_3\downarrow+3Na_2SO_4\\ FeSO_4+2NaOH\to Fe(OH)_2\downarrow+Na_2SO_4\\ \Rightarrow n_{Al(OH)_3}=x;n_{Fe(OH)_2}=y\\ \Rightarrow 78x+90y=24,6(2)\\ (1)(2)\Rightarrow \begin{cases} x=0,2(mol)\\ y=0,1(mol) \end{cases} \Rightarrow \begin{cases} m_{Al}=0,2.27=5,4(g)\\ m_{Fe}=11-5,4=5,6(g) \end{cases}\)
\(b,\Sigma n_{H_2SO_4}=1,5x+y=0,4(mol)\\ \Rightarrow V_{dd_{H_2SO_4}}=\dfrac{0,4}{0,2}=2(l)\\ c,\Sigma n_{NaOH}=3x+2y=0,8(mol)\\ \Rightarrow m_{dd_{NaOH}}=\dfrac{0,8.40}{10\%}=320(g)\\ d,2Al(OH)_3\xrightarrow{t^o}Al_2O_3+3H_2O\\ Fe(OH)_2\xrightarrow{t^o}FeO+H_2O\\ \Rightarrow n_{Al_2O_3}=0,1(mol);n_{FeO}=0,1(mol)\\ \Rightarrow m_{\text{chất rắn}}=0,1.102+0,1.72=17,4(g)\)

Gọi số mol Al, Fe là a, b (mol)
=> 27a + 56b = 2,22 (1)
\(n_{HNO_3}=0,5.0,5=0,25\left(mol\right)\)
\(n_{NO}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
Có nHNO3 > 4.nNO => HNO3 dư
PTHH: \(Al+4HNO_3\rightarrow Al\left(NO_3\right)_3+NO+2H_2O\)
_______a------>4a------------->a----------->a____________(mol)
\(Fe+4HNO_3\rightarrow Fe\left(NO_3\right)_3+NO+H_2O\)
_b------>4b------------>b------------>b__________________(mol)
=> a + b = 0,05 (2)
(1)(2) => \(\left\{{}\begin{matrix}a=0,02\left(mol\right)\\b=0,03\left(mol\right)\end{matrix}\right.\)
=> A \(\left\{{}\begin{matrix}n_{Al\left(NO_3\right)_3}=0,02\left(mol\right)\\n_{Fe\left(NO_3\right)_3}=0,03\left(mol\right)\\n_{HNO_3\left(dư\right)}=0,05\left(mol\right)\end{matrix}\right.\)
\(n_{NaOH}=1.0,21=0,21\left(mol\right)\)
PTHH: \(HNO_3+NaOH\rightarrow NaNO_3+H_2O\)
_______0,05------->0,05_______________________(mol)
\(Fe\left(NO_3\right)_3+3NaOH\rightarrow Fe\left(OH\right)_3\downarrow+3NaNO_3\)
__0,03---------->0,09---------->0,03_______________(mol)
\(Al\left(NO_3\right)_3+3NaOH\rightarrow3NaNO_3+Al\left(OH\right)_3\downarrow\)
_-0,02----------->0,06------------------------->0,02_____(mol)
\(2Fe\left(OH\right)_3\underrightarrow{t^o}Fe_2O_3+3H_2O\)
__0,03-------->0,015__________________(mol)
\(2Al\left(OH\right)_3\underrightarrow{t^o}Al_2O_3+3H_2O\)
__0,02-------->0,01___________________(mol)
=> \(m_{rắn}=0,015.160+0,01.102=3,42\left(g\right)\)

\(2Na+2H_2O\rightarrow2NaOH+H_2\)
\(2Al+2NaOH+2H_2O\rightarrow2NaAlO_2+3H_2\)
- Số mol H2: \(n=\dfrac{V}{22,4}=\dfrac{0,448}{22,4}=0,02mol\)
- Chất rắn B chứa 2 kim loại là Fe và Al dư và theo PTHH 1 và 2 ta có số mol Al phản ứng 2= số mol NaOH=số mol Na
\(n_{CuSO_4}=\dfrac{200.4,8}{160.100}=0,06mol\)
2Al+3CuSO4\(\rightarrow\)Al2(SO4)3+3Cu
Fe+CuSO4\(\rightarrow\)FeSO4+Cu
\(n_{Cu}=\dfrac{3,2}{64}=0,05mol< n_{CuSO_4}=0,06mol\)
nên dung dịch C gồm Al2(SO4)3; FeSO4; CuSO4 dư 0,01 mol
- Tóm tắt: (Al2(SO4)3; FeSO4; CuSO4 )+NaOH\(\rightarrow\)(Al(OH)3; Fe(OH)2; Cu(OH)2)\(\overset{t^0}{\rightarrow}\) D(Al2O3; Fe2O3; CuO)
- Trong 2,16 gam hỗn hợp ta gọi số mol Na là x, Al phản ứng 2 là x và phản ứng 3 là a, Fe là z.
- Ta có: 23x+27(x+a)+56z=2,16 hay 50x+27a+56z=2,16
- Theo PTHH 1 và 2: \(n_{H_2}=\dfrac{1}{2}x+\dfrac{3}{2}x=0,02\) suy ra x=0,01
- Theo PTHH 3 và 4: \(n_{Cu}=\dfrac{3}{2}a+z=0,05\)
- Giải hệ:\(\left\{{}\begin{matrix}x=0,01\\50x+27a+56z=2,16\\\dfrac{3}{2}a+z=0,05\end{matrix}\right.\)
- Ta được: x=0,01; a=0,02; z=0,02
- Trong 2,16 g hỗn hợp có: Na 0,01 mol; Al 0,03 mol; Fe 0,02 mol)
- Vậy khối lượng từng kim loại trong A: Na=0,23g; Al=0,81g; Fe=1,12g
-Trong D có( Al2O3=\(\dfrac{1}{2}\)a=0,01 mol; Fe2O3 =\(\dfrac{1}{2}\)z=0,01mol; CuO=0,01mol)
\(m_D=0,01.102+0,01.160+0,01.80=3,42g\)
- Dung dịch C gồm Al2(SO4)3=0,01 mol; FeSO4= 0,02 mol; CuSO4 dư 0,01 mol
- Khối lượng dung dịch:
m=2,16+200-0,02.2-3,2=198,92g
\(\%m_{Al_2\left(SO_4\right)_3}=\dfrac{0,01.342.100}{198,92}\simeq1,72\%\)
\(\%m_{FeSO_4}=\dfrac{0,02.152.100}{198,92}\simeq1,53\%\)
\(\%m_{CuSO_4}=\dfrac{0,01.160.100}{198,92}\simeq0,8\%\)
tks bạn nha !! bạn học giỏi thật !! có gì chỉ mình thêm mấy bài tập Hóa nữa nha

Đặt:\(\left\{{}\begin{matrix}CaCO_3;KHCO_3:x\left(mol\right)\\KCl:y\left(mol\right)\end{matrix}\right.\)
\(\left\{{}\begin{matrix}x=nCO_2=0,2\left(mol\right)\\100x+74,5y=34,9\end{matrix}\right.\)
Khi cho Y tác dụng với HCl thì:
\(nAgCl=nKCl+nHCl=0,2+0,4=0,6\left(mol\right)\)
\(\Rightarrow mAgCl=0,6.143,5=86,1\left(gam\right)\)

n O H - = 2 n H 2 = 2.6,72/22,4 = 0,6 mol
Cho X tác dụng với A l N O 3 3 , đạt kết tủa lớn nhất khi A l O H 3 tạo ra chưa bị hòa tan bởi các hidroxit kiềm, kiềm thổ trong X, khi đó:
A l 3 + + 3 O H - → A l O H 3
⇒ n A l O H 3 = 1/3 n O H - = 1/3 . 0,6 = 0,2 mol
⇒ m↓ = m A l O H 3 = 0,2.78 = 15,6g
⇒ Chọn B.