Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

2M+nH2S04--->M2(S04)n+nH2
nH2=0.672/22.4=0.03(mol)
Theo pthh
\(n_M=\frac{2}{n}n_{H2}=\frac{0,06}{n}\left(mol\right)\)
Mà n\(_M=0,02\rightarrow n=3\)
Vậy kim loại M có hóa trị III.
PTHH:2M+3CuS04=>M2(S04)3+3Cu
Theo pthh
n Cu=\(\frac{3}{2}n_M=0,03\left(mol\right)\)
Ta có:
64.(0.03)=3.555.0.02.M
<=>M=27
Vậy M là nhôm (Al)

nH2 = 0,13 mol; nSO2 = 0,25 mol
Ta có
2H+ + 2e → H2 Cu → Cu2+ + 2e
0,26 ←0,13 0,12 0,24
S+6 + 2e → S+4
0,5 ← 0,25
TH1: M là kim loại có hóa trị không đổi
=> nCu = (0,5 – 0,26) : 2 = 0,12 mol => mCu = 7,68g
=> mM = 3,12g (loại vì khối lượng của M lớn hơn của Cu)
TH2: M là kim loại có hóa trị thay đổi
Do M không có hóa trị I do đó khi phản ứng với HCl thì M thể hiện hóa trị II
M + 2HCl → MCl2 + H2
0,13 ← 0,13
Do M có hóa trị thay đổi => khi phản ứng với H2SO4 đặc nóng thì M thể hiện hóa trị III
2M + 6H2SO4 → M2(SO4)3 + 3SO2 + 6H2O
0,13 → 0,195
Cu + 2H2SO4 → CuSO4+ SO2 + 2H2O
0,055 ← 0,055
=> mM = 10,8 – 0,055 . 64 = 7,28g
=> MM = 56 => Fe
Ta có số mol của Cu và Fe trong 10,8 g lần lượt là 0,055 và 0,13 mol
=> Trong 5,4g có số mol Cu và Fe lần lượt là 0,0275 và 0,065 mol
nAgNO3 = 0,16mol
Fe + 2AgNO3 → Fe(NO3)2 +2Ag
0,065 0,13 0,065 0,13
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
0,015 0,03 0,03
=> nCu dư = 0,0275 – 0,015 = 0,0125mol
m = mCu dư + mAg = 0,0125 . 64 + 0,16 . 108 = 18,08g

m rắn giảm = mO (oxit) => nO (oxit) = (1,6 – 1,408) : 16 = 0,012mol
Dễ thấy n = nO (oxit) = 0,012mol
=> nH2 ban đầu = 0,012 : 80% = 0,015
=> nFe = nH2= 0,015 → x = 0,015
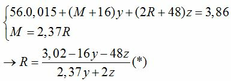
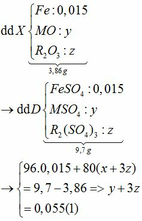
Ta có: CO + O(Oxit) → CO2
Vì: m(Rắn giảm) = mO(Oxit) → nO(Oxit) = (3,86 – 3,46) : 16 = 0,025
TH1: cả 2 oxit đều bị khử bởi CO
→ nO(Oxit) = y + 3z = 0,025 kết hợp với (1) loại
TH2: chỉ có MO bị khử bởi CO
→ nO(Oxit) = nMO = 0,025 → y = 0,025 kết hợp với (1) => z = 0,01
Kết hợp với (*) => M = 64 (Cu)
TH3: chỉ có R2O3 bị khử bởi CO
→ nO(Oxit) = 3.nR2O3 → z = 0,025/3 kết hợp với (1) => y = 0,03
Kết hợp với (*) y => M lẻ => loại
Vậy %m các chất trong X là: 21,76%; 51,81%; 26,43%

a)
$Fe_2O_3 + 3CO \xrightarrow{t^o} 2Fe +3 CO_2$
$Fe + 2HCl \to FeCl_2 + H_2$
$RO + H_2 \xrightarrow{t^o} R + H_2O$
b)
Coi m = 160(gam)$
Suy ra: $n_{Fe_2O_3} = 1(mol)$
Theo PTHH :
$n_{RO} = n_{H_2} = n_{Fe} = 2n_{Fe_2O_3} = 2(mol)$
$M_{RO} = R + 16 = \dfrac{160}{2} = 80 \Rightarrow R = 64(Cu)$
Vậy oxit là CuO

Phương trình hóa học của phản ứng:
M + n/2HCl → M Cl n
M + mHCl → M Cl m + m/2 H 2
Theo đề bài, ta có:
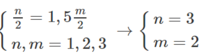
và M + 106,5 = 1,2886 (M+71)
Giải ra, ta có M = 52 (Cr)

\(n_{H2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
a) Pt : \(Mg+H_2SO_4\rightarrow MgSO_4+H_2|\)
1 1 1 1
0,05 0,05
b) \(n_{Mg}=\dfrac{0,05.1}{1}=0,05\left(mol\right)\)
⇒ \(m_{Mg}=0,05.24=1,2\left(g\right)\)
Chúc bạn học tốt



Thí nghiệm 2 : 2M + nH2SO4 ---> M2(SO4)n + nH2
Theo pthh : nH2 = \(\dfrac{n}{2}n_M\)
=> 0,02 = \(\dfrac{n}{2}.0,02\)
=> n = 2 => M hóa trị II
Thí nghiệm 1 : Đặt nM = x (mol)
M + CuSO4 ---> MSO4 + Cu
Theo pthh : nCu = nM = x (mol)
=> \(\dfrac{m_{Cu\left(spu\right)}}{m_{M\left(bandau\right)}}=\dfrac{64x}{M_Mx}=\dfrac{64}{M_M}=1,143\Rightarrow M_M=56\) (g/mol)
Vậy kim loại M là Fe (Sắt)