Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a)
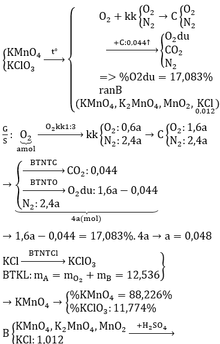
\(2KMnO_4\xrightarrow[]{t^o}K_2MnO_4+MnO_2+O_2\) (1)
\(2KClO_3\xrightarrow[]{t^o}2KCl+3O_2\) (2)
\(n_{KCl}=\dfrac{0,894}{74,5}=0,012\left(mol\right);m_B=\dfrac{0,894}{8,132\%}=11\left(g\right)\)
Gọi \(n_{O_2\left(sinh.ra\right)}=a\left(mol\right)\Rightarrow n_{kk}=3a\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}n_{N_2}=3a.80\%=2,4a\left(mol\right)\\n_{O_2}=a+\left(3a-2,4a\right)=1,6a\left(mol\right)\end{matrix}\right.\)
\(n_C=\dfrac{0,528}{12}=0,044\left(mol\right)\)
\(C+O_2\xrightarrow[]{t^o}CO_2\) (3)
Vì hỗn hợp D gồm 3 khí và O2 chiếm 17,083%
\(\Rightarrow D:CO_2,O_{2\left(d\text{ư}\right)},N_2\)
BTNT C: \(n_{CO_2}=n_C=0,044\left(mol\right)\)
BTNT O: \(n_{O_2\left(d\text{ư}\right)}=n_{O_2\left(b\text{đ}\right)}-n_{CO_2}=1,6a-0,044\left(mol\right)\)
\(\Rightarrow\%V_{O_2}=\%n_{O_2}=\dfrac{1,6a-0,044}{1,6a-0,044+0,044+2,4a}.100\%=17,083\%\)
\(\Leftrightarrow a=0,048\left(mol\right)\left(TM\right)\)
ĐLBTKL: \(m_A=m_B+m_{O_2}=11+0,048.32=12,536\left(g\right)\)
Theo PT (2): \(n_{KClO_3}=n_{KCl}=0,012\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{KClO_3}=\dfrac{0,012.122,5}{12,536}.100\%=11,63\%\\\%m_{KMnO_4}=100\%-11,63\%=88,37\%\end{matrix}\right.\)
b) Theo PT (2): \(n_{O_2}=\dfrac{1}{2}n_{KMnO_4\left(p\text{ư}\right)}+\dfrac{3}{2}n_{KClO_3}\)
\(\Rightarrow n_{KMnO_4\left(p\text{ư}\right)}=2.\left(0,048-\dfrac{3}{2}.0,012\right)=0,06\left(mol\right)\)
\(n_{KMnO_4\left(b\text{đ}\right)}=\dfrac{12,536-0,012.122,5}{158}=0,07\left(mol\right)\)
\(\Rightarrow n_{KMnO_4\left(d\text{ư}\right)}=0,07-0,06=0,01\left(mol\right)\)
\(n_{KCl}=\dfrac{74,5}{74,5}+0,012=1,012\left(mol\right)\)
Theo PT (1): \(n_{K_2MnO_4}=n_{MnO_2}=\dfrac{1}{2}.n_{KMnO_4\left(p\text{ư}\right)}=0,03\left(mol\right)\)
PTHH:
\(2KMnO_4+10KCl+8H_2SO_4\rightarrow6K_2SO_4+2MnSO_4+5Cl_2+8H_2O\) (4)
\(K_2MnO_4+4KCl+4H_2SO_4\rightarrow3K_2SO_4+MnSO_4+2Cl_2+4H_2O\) (5)
\(MnO_2+2KCl+2H_2SO_4\rightarrow MnSO_4+K_2SO_4+Cl_2+2H_2O\) (6)
\(2KCl+H_2SO_4\xrightarrow[]{t^o}K_2SO_4+2HCl\) (7)
Theo PT (4), (5), (6): \(n_{KCl\left(p\text{ư}\right)}=5n_{KMnO_4\left(d\text{ư}\right)}+4n_{K_2MnO_4}+2n_{MnO_2}=0,23\left(mol\right)< 1,012\left(mol\right)=n_{KCl\left(b\text{đ}\right)}\)
`=> KCl` dư
Theo PT (4), (5), (6): \(n_{Cl_2}=\dfrac{1}{2}.n_{KCl\left(p\text{ư}\right)}=0,115\left(mol\right)\)
\(\Rightarrow V_{kh\text{í}}=V_{Cl_2}=0,115.22,4=2,576\left(l\right)\)

\(n_{C_2H_4}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\\ PTHH:C_2H_4+3O_2\rightarrow\left(t^o\right)2CO_2+2H_2O\\ n_{O_2}=3.0,4=1,2\left(mol\right);n_{CO_2}=0,4.2=0,8\left(mol\right)\\ a,V_{O_2\left(đktc\right)}=22,4.1,2=26,88\left(l\right)\\ b,V_{kk\left(đktc\right)}=\dfrac{100}{20}.26,88=134,4\left(l\right)\\ c,CO_2+Ca\left(OH\right)_2\rightarrow CaCO_3\downarrow\left(trắng\right)+H_2O\\ n_{CaCO_3}=n_{CO_2}=0,8\left(mol\right)\\ m_{kết.tủa}=m_{CaCO_3}=100.0,8=80\left(g\right)\)

a)
\(n_{H_2O}=\dfrac{4,5}{18}=0,25\left(mol\right)\)
PTHH: C2H4 + 3O2 --to--> 2CO2 + 2H2O
0,125<-0,375<-------------0,25
=> V = 0,125.22,4 = 2,8 (l)
b) VO2 = 0,375.22,4 = 8,4 (l)
=> Vkk = 8,4 : 20% = 42 (l)

a, \(CH_4+2O_2\underrightarrow{^{t^o}}CO_2+2H_2O\)
\(C_2H_4+3O_2\underrightarrow{^{t^o}}2CO_2+2H_2O\)
b, Gọi: \(\left\{{}\begin{matrix}n_{CH_4}=x\left(mol\right)\\n_{C_2H_4}=y\left(mol\right)\end{matrix}\right.\) \(\Rightarrow x+y=\dfrac{4,48}{22,4}=0,2\left(mol\right)\left(1\right)\)
Theo PT: \(n_{O_2}=2n_{CH_4}+3n_{C_2H_4}=2x+3y=\dfrac{15,68}{22,4}=0,7\left(mol\right)\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=-0,1\\y=0,3\end{matrix}\right.\)
Đến đây thì ra số mol âm, bạn xem lại đề nhé.
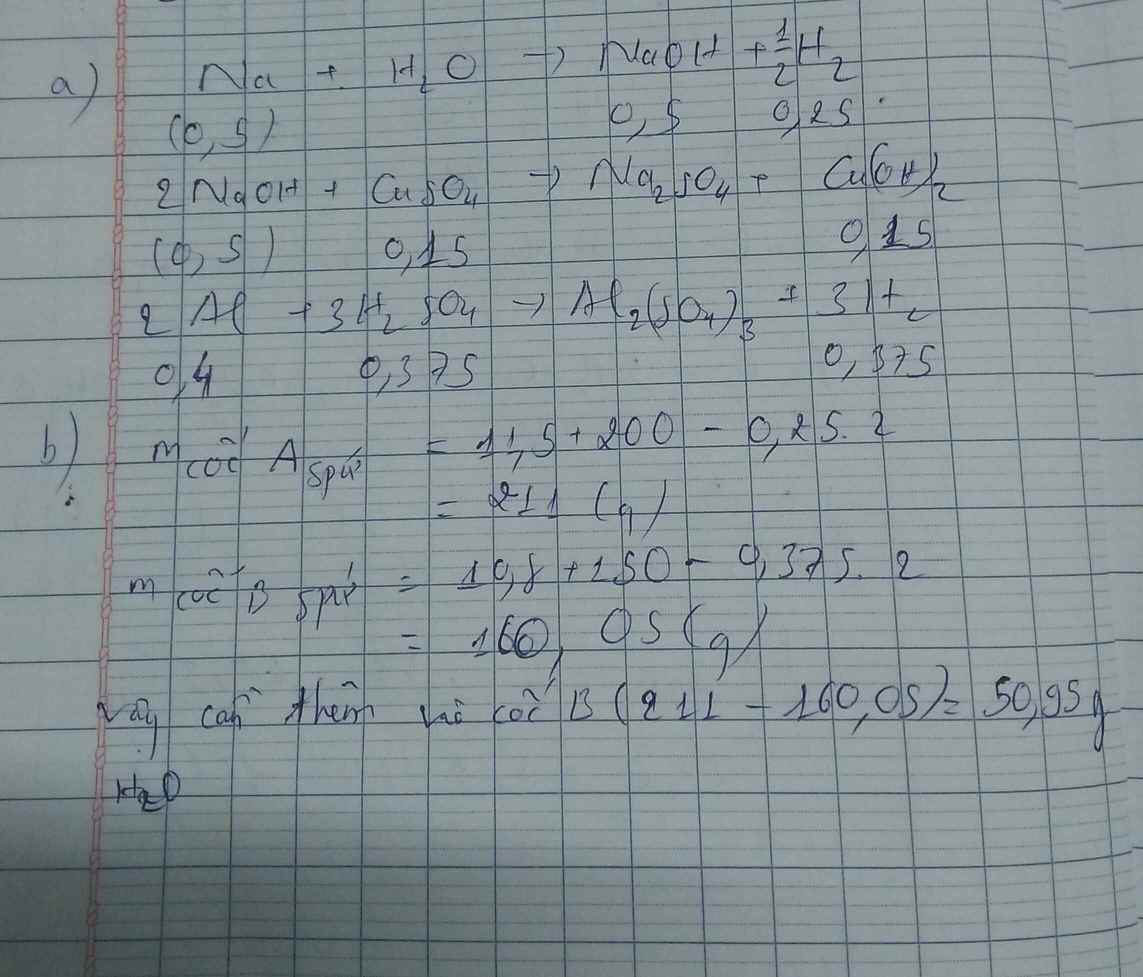
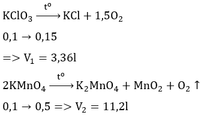
\(n_{KClO_3}=\dfrac{m}{M}=\dfrac{24,5}{122,5}=0,2\left(mol\right)\\PTHH:2KClO_3\underrightarrow{t^o}2KCl+3O_2\)
Theo pthh: \(n_{O_2}=\dfrac{3}{2}n_{KClO_3}=0,3\left(mol\right)\Rightarrow V_{O_2}=n.22,4=0,3.22,4=6,72\left(l\right)\)
\(n_{KClO_3}\)=24,5 : ( 39 + 35,5 + 16.3 ) = 0,2 mol
PTHH: 2KClO3 -> 2KCl + 3O2
0,2mol --> 0,3mol
=> \(V_{O_2}\) thu được = 0,3 . 22,4 = 6,72 lít (đktc)